Suivez ces règles dans l`ordre indiqué ci-dessous : Tout Na, K et NH4 les sels sont solubles. Tous NON3, C2hein3ô2, ClO3 et ClO4 les sels sont solubles. Tout Ag, Pb et Hg2 les sels ne sont pas solubles. Tous les sels de Cl, Br et I sont solubles. Tout CO3, O, S, OH, PO4, CrO4, cr2ôsept et donc3 les sels ne sont pas solubles (à quelques exceptions près). Tous SO4 les sels sont solubles (à quelques exceptions près). 
Par exemple, dans NaCl, Na est le cation chargé positivement car c`est un métal tandis que Cl est l`anion chargé négativement car c`est un non-métal. 
Si vous suivez un cours de chimie standard, vous devrez probablement mémoriser certains des ions polyatomiques les plus courants. Quelques ions couramment utilisés sont le CO3, NON3, NON2, ALORS4, ALORS3, ClO4 et ClO3. Il y en a beaucoup plus, que vous pouvez trouver dans les tableaux de votre manuel de chimie ou en ligne. 

Si aucun état n`est indiqué pour un élément, utilisez l`état comme indiqué dans le tableau périodique. Si un composé est dit être une solution, enregistrez-le comme liquide ou (aq). S`il y a de l`eau dans l`équation, déterminez si la liaison ionique va se dissoudre, en utilisant une table de solubilité. Si la solubilité est élevée, le composé est liquide (aq), s`il a une faible solubilité, alors c`est un solide (s). S`il n`y a pas d`eau, alors la liaison ionique est un solide (s). Si le problème concerne un acide ou une base, alors la liaison sera liquide (aq). Par exemple, 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni. Cr et Ni sont des solides sous leur forme élémentaire. NiCl2 et CrCl3 sont des liaisons ioniques solubles et sont donc liquides. Si vous réécrivez l`équation, cela devient : 2Cr(s) + 3NiCl2(aq) --> 2CrCl3(aq) + 3Ni(s). 
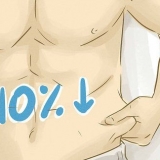
Les solides, les liquides, les gaz, les liaisons moléculaires, les liaisons ioniques peu solubles, les ions polyatomiques et les acides faibles ne se décomposent pas. Les liaisons ioniques à haute solubilité (utilisez un tableau de solubilité) et les acides forts s`ioniseront à 100 % (HCl(aq), HBr(aq), SALUT(aq), hein2ALORS4(aq), HClO4(aq) et HNO3(aq)). Gardez à l`esprit que bien que les ions polyatomiques ne se décomposent pas davantage, ils se sépareront d`une liaison ionique s`ils sont un composant de ce composé. 
Dans notre exemple : NiCl2 se décompose en Ni et Cl tandis que CrCl3 se décompose en Cr et Cl. Ni a une charge de 2+ car Cl a une charge négative, mais il y en a 2 atomes. Il doit donc y avoir un équilibre entre les 2 ions Cl- négatifs. Cr a une charge de 3+ car il doit équilibrer les 3 ions Cl- négatifs. Rappelez-vous que les ions polyatomiques ont leur propre charge spécifique. 
Les solides, les liquides, les gaz, les acides faibles et les liaisons ioniques peu solubles ne changeront pas d`état ou ne se diviseront pas en ions. Laissez-les simplement comme ils sont. Les substances moléculaires se disperseront dans une solution de sorte que leur état se transforme en liquide (aq). Trois exceptions qui non liquide (aq) deviennent sont : CH4(g), C3hein8(g) et C8hein18(je). En continuant avec l`exemple, l`équation ionique complète ressemble à ceci : 2Cr(s) + 3Ni(aq) + 6cl(aq) --> 2Cr(aq) + 6cl(aq) + 3Ni(s). Lorsque Cl ne fait pas partie d`un composé, alors il n`est pas diatomique; nous avons donc multiplié le coefficient par le nombre d`atomes dans le composé, pour obtenir 6 ions Cl des deux côtés de l`équation. 
Développez l`exemple : il y a 6Cl d`ions en excès de chaque côté de l`équation qui peuvent être éliminés. L`équation finale des ions nets est 2Cr(s) + 3Ni(aq) --> 2Cr(aq) + 3Ni(s). Vous pouvez vérifier si votre réponse est correcte en vérifiant si les charges totales des deux côtés de l`équation de réaction sont égales.
Création d'une équation d'ions nets
Teneur
Les équations d`ions nets sont un aspect important de la chimie car elles ne représentent que les entités qui changent dans une réaction chimique. Ils sont principalement utilisés dans les réactions d`oxydoréduction, les réactions de double remplacement et les neutralisations acido-basiques. Il y a trois étapes de base pour écrire une équation d`ions nets : rendre l`équation moléculaire égale, la convertir en une équation d`ions complète (comment chaque substance existe dans une solution), puis écrire l`équation d`ions nets.
Pas
Partie 1 sur 2: Comprendre les composants d`une équation ionique

1. Connaître la différence entre moléculaire etcomposés ioniques. La première étape de l`écriture d`une équation ionique nette consiste à distinguer les liaisons ioniques de la réaction. Les liaisons ioniques sont les composés qui s`ionisent dans une solution aqueuse et ont une charge. Les liaisons moléculaires sont des composés qui n`ont jamais de charge. Ils se composent de deux non-métaux et sont parfois appelés liaisons covalentes.
- Des liaisons ioniques peuvent se former entre les métaux et les non-métaux, les métaux et les ions polyatomiques ou plusieurs ions polyatomiques.
- Si vous n`êtes pas sûr d`un composé, recherchez les éléments du composé dans le tableau périodique.

2. Déterminer la solubilité d`une substance. Toutes les liaisons ioniques ne sont pas solubles dans une solution aqueuse et ne se décomposeront donc pas en ions phosphate individuels. Vous devez connaître la solubilité de chaque substance avant de passer au reste de l`équation. Voici un bref résumé des règles de solubilité. Trouvez un tableau de solubilité pour plus d`informations et les exceptions à ces règles.

3. Déterminer le cation et l`anion dans une composition. Les cations sont les ions positifs dans un composé et généralement les métaux. Les anions sont les ions négatifs non métalliques du composé. Certains non-métaux sont capables de former des cations, mais les métaux forment toujours des cations.

4. Reconnaître les ions polyatomiques dans la réaction. Les ions polyatomiques sont des molécules si étroitement liées qu`elles ne se désintègrent pas du tout lors des réactions chimiques. Il est important de pouvoir reconnaître les ions polyatomiques car ils ont une charge spécifique et ne se décomposent pas en leurs composants individuels. Les ions polyatomiques peuvent être chargés positivement ou négativement.
Partie 2 sur 2: Une équation d`ions nets

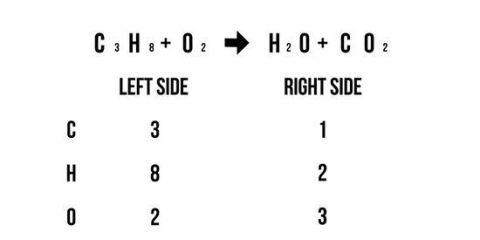
1. Assurez-vous que l`équation de réaction est en équilibre. Avant de pouvoir écrire une équation d`ions nets, vous devez d`abord vous assurer que l`équation initiale est complètement est en équilibre. Pour rendre une équation égale des deux côtés de la flèche de réaction, placez des coefficients pour les composés jusqu`à ce qu`il y ait un nombre égal d`atomes pour chaque élément, des deux côtés de l`équation.
- Écrivez le nombre d`atomes qui composent chaque composé de chaque côté de l`équation.
- Placez un coefficient pour chaque élément qui n`est pas de l`oxygène ou de l`hydrogène pour équilibrer l`équation.
- Rendre le nombre d`atomes d`hydrogène égal des deux côtés.
- Rendre le nombre d`atomes d`oxygène égal des deux côtés.
- Comptez à nouveau le nombre d`atomes de chaque côté de l`équation pour vous assurer qu`ils sont égaux.
- Par exemple, Cr + NiCl2 --> ClCr3 + Ni devient 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni.

2. Déterminer les états de chaque composé dans l`équation. Vous pourrez souvent indiquer des mots-clés dans une déclaration, qui indiquent clairement l`état de chaque connexion. Il existe un certain nombre de règles pour déterminer l`état d`un élément ou d`un composé.

3. Déterminer quelles espèces se décomposeront (en cations et anions individuels) dans la solution. Lorsqu`une substance ou un composé particulier se décompose, il se décompose en ses composants positifs (cations) et négatifs (anions). Ce sont les composants qui finissent par s`équilibrer les uns avec les autres et aboutissent ainsi à l`équation d`ions nets.

4. Calculer la charge de chaque ion séparé. Rappelez-vous que les métaux sont le cation positif tandis que les non-métaux sont l`anion négatif. Avec le tableau périodique, vous pouvez déterminer quel élément a quelle charge. Vous devez également équilibrer la charge de chaque ion dans le composé.

5. Écrivez l`équation avec les liaisons ioniques solubles décomposées en leurs ions individuels. Tout ce qui se décompose ou s`ionise (acides forts) se divisera en deux ions différents. L`état de la matière reste le même (aq), mais notez que l`équation reste en équilibre.

6. Supprimer les ions superflus en éliminant les ions identiques de chaque côté de l`équation. Vous ne pouvez vous débarrasser que des ions complètement identiques des deux côtés (charge, indice, etc.). Réécrire la réaction sans aucune des substances éliminées.
Des astuces
- Énoncer tous les états des substances dans toutes les équations. Vous obtiendrez certainement des points déduits si vous ne le faites pas.
Articles sur le sujet "Création d'une équation d'ions nets"
Оцените, пожалуйста статью
Similaire
Populaire