Par exemple : hexafluorure de diazote. Le premier élément est l`azote et le symbole chimique de l`azote est N. 
Par exemple : Dinitrogen a le préfixe `di-` signifiant 2 ; Il y a donc deux atomes d`azote présents. Écrire le diazote sous la forme N2. 
Par exemple : Hexafluorure de diazote. Le deuxième élément est le fluor. Omettez simplement la fin `-ide` pour obtenir le nom réel de l`élément. Le symbole chimique du fluor est F. 
Par exemple : l`hexafluorure a le préfixe « hexa- » signifiant 6 ; C`est pourquoi il y a 6 atomes de fluor présents. Écrire l`hexafluorure comme F6. La formule chimique finale de l`hexafluorure de diazote est N2F6. 
Dioxyde de soufre : SO2 Tétrabromure de carbone : CBr4 Pentoxyde de diphosphore : P2ô5 

Il n`y a que 3 cations polyatomiques, et ce sont l`ammonium (NH4), hydronium (H3) et le mercure (I) (Hg2 Le reste des ions polyatomiques ont des charges négatives allant de -1 à -4. Quelques exemples courants sont le carbonate (CO3), sulfate (SO4), nitrate (NON3) et le chromate (CrO4). 
Tous les éléments du groupe 1 sont 1+. Tous les éléments du groupe 2 sont 2+. Les éléments de transition ont des chiffres romains pour indiquer leur charge. L`argent est 1+ Le zinc est 2+ et l`aluminium est 3+. Le groupe 17 est 1-. Le groupe 16 est 2-. Le groupe 15 est 3-. Rappelez-vous que lorsque vous avez affaire à des ions polyatomiques, vous pouvez simplement profiter de la charge de l`ion. 
Par exemple : oxyde de lithium. Le lithium est un élément du groupe 1 et a une charge de 1+. L`oxygène est un élément du groupe 16 et a une charge de 2-. Pour équilibrer la charge 2- d`oxygène, il faut 2 atomes de lithium ; Par conséquent, la formule chimique de l`oxyde de lithium est Li2ô. 
Nitrure de calcium : Le symbole du calcium est Ca et le symbole de l`azote est N. Ca est un élément du groupe 2 et a une charge de 2+. L`azote est un élément du groupe 15 et a une charge de 3-. Pour équilibrer cela, vous avez besoin de 3 atomes de calcium (6 +) et 2 atomes d`azote (6-): Ca3N2. Phosphate de mercure (II) : Le symbole du mercure est Hg et le phosphate est l`ion polyatomique PO PO4. Mercure a une charge de 2+ comme indiqué à côté par le chiffre romain II. Le phosphate a une charge de 3-. Pour les équilibrer, vous avez besoin de 3 atomes de mercure (6+) et de 2 molécules de phosphate (6-) : Hg3(bon de commande4)2. 

N`oubliez pas d`équilibrer les charges lors de la formation de nouveaux composés. Par exemple : AgNO3 + NaCl --> ? Ag est maintenant couplé à Cl pour former AgCl. Na est maintenant lié à NO3 à NaNO3 façonner. 
Par exemple : AgNO3 + NaCl --> ? AgNO3 + NaCl --> AgCl + NaNO3 
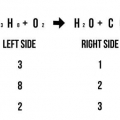
Par exemple : AgNO3 + NaCl --> AgCl + NaNO3 Comptez le nombre d`atomes des deux côtés : 1 Ag à gauche, 1 Ag à droite ; 1 N à gauche, 1 N à droite ; 3 O à gauche, 3 O à droite ; 1 Après la gauche, 1 Après la droite ; 1 cl à gauche, 1 cl à droite. Cette équation de réaction est en équilibre car il y a le même nombre d`atomes à gauche et à droite de l`équation. 
NiCl2 + (NH4)2s --> ? Cations : Ni et NH4 Anions : Cl et S Réorganiser les ions pour créer de nouveaux produits : NiS + NH4Cl Écrire l`équation : NiCl2 + (NH4)2s --> NiS + NH4Cl Équilibrer l`équation : NiCl2 + (NH4)2s --> NiS + 2NH4Cl
Faire une équation chimique
Teneur
Une bonne façon de penser à une réaction chimique est le processus de cuisson des biscuits. Vous mélangez les ingrédients (farine, beurre, sel, sucre et œufs), faites cuire la pâte et vous la voyez se transformer en quelque chose de nouveau. Biscuits. En termes chimiques, la recette est l`équation, les ingrédients sont les « réactifs » et les biscuits sont les « produits ». Toutes les équations de réaction ressemblent à `A + B --> C (+ D..)`, où chaque lettre majuscule est un élément ou une molécule (un ensemble d`atomes maintenus ensemble par des liaisons chimiques). La flèche indique la réaction ou le changement en cours. Pour écrire les équations, vous devez connaître certaines règles de nommage importantes.
Pas
Partie1 sur 3: Écrire des formules chimiques de liaisons covalentes

1. Apprenez les préfixes pour le nombre d`atomes. Lors de la dénomination des composés, les préfixes grecs sont utilisés pour indiquer le nombre d`atomes présents dans chaque élément. Les liaisons covalentes ont le premier élément écrit en entier, tandis que le deuxième élément reçoit un suffixe « -ide ». Par exemple, le trisulfure de pentaoxyde de diphosphore a la formule chimique P2s3. Voici les préfixes pour 1-10 :
- 1 : Mono-
- 2: Di-
- 3: Tri-
- 4: Tétra-
- 5: Penta-
- 6 : Hexa-
- 7 : Hepta-
- 8 : Octa-
- 9: Nona-
- 10 : Déca-

2. Notez le symbole chimique du premier élément. Lorsqu`un composé est écrit, vous devez indiquer les éléments et connaître leurs symboles chimiques. Le premier élément qui est écrit est le `prénom` de la composition. Utilisez le tableau périodique pour trouver le symbole chimique d`un élément.

3. Ajouter le nombre d`atomes en indice. Pour identifier le nombre d`atomes présents pour chaque élément, il suffit de regarder le préfixe de l`élément. Mémoriser les préfixes grecs vous aidera à écrire rapidement des formules chimiques, sans avoir à chercher quoi que ce soit.

4. Notez le symbole chimique du deuxième élément. Le deuxième élément est le "nom de famille" de la substance et suit le premier élément. Dans les liaisons covalentes, les noms des éléments ont le suffixe `-ide` au lieu de la terminaison normale de l`élément.

5. Ajouter en indice le nombre d`atomes présents. Comme pour le premier élément, vous déterminez le nombre d`atomes dans le deuxième élément en lisant le préfixe. Avec ce préfixe, vous écrivez le nombre d`atomes en indice à droite du symbole chimique.

6. Entraînez-vous avec quelques exemples. Si vous débutez en chimie, il y a beaucoup à mémoriser. C`est comme apprendre une nouvelle langue. Plus vous vous entraînerez avec des exemples de problèmes, plus il vous sera facile de déchiffrer des formules chimiques à l`avenir et d`apprendre le langage de la chimie.
Partie 2 sur 3: Écrire des formules chimiques de liaisons ioniques

1. Déterminer les symboles chimiques des cations et des anions. Tous les produits chimiques ont un prénom et un nom. Le prénom est le cation (ion positif) tandis que le nom de famille est l`anion (ion négatif). Les cations sont écrits comme nom d`élément tandis que les anions sont le nom de l`élément qui se termine par le suffixe « -ide ».
- Le symbole chimique de chaque élément se trouve dans le tableau périodique.
- Contrairement aux liaisons covalentes, les préfixes grecs ne sont pas utilisés pour indiquer le nombre d`atomes de chaque élément. Il faut équilibrer les charges des éléments, pour déterminer le nombre d`atomes.
- Par exemple : l`oxyde de lithium est Li2ô.

2. Reconnaître les ions polyatomiques. Parfois, le cation ou l`anion est un ion polyatomique. Ce sont des molécules qui contiennent deux atomes ou plus avec des groupes ioniques. Il n`y a pas d`astuce pour s`en souvenir, vous n`aurez qu`à les mémoriser.

3. Déterminer la valence de chaque élément. La valence peut être déterminée en regardant la position de l`élément dans le tableau périodique. Il y a quelques règles à garder à l`esprit qui peuvent vous aider à déterminer les charges :

4. Équilibrer les charges positives et négatives des ions. Une fois que vous avez déterminé la charge de chaque élément (ou ion polyatomique), vous utiliserez ces charges pour déterminer le nombre d`atomes présents dans chaque élément. L`intention est de mettre la charge du composé à zéro, donc vous allez ajouter des atomes pour équilibrer les charges.

5. Entraînez-vous avec quelques exemples. La meilleure façon d`apprendre à écrire des formules est de s`entraîner avec de nombreux exemples. Utilisez des exemples dans votre manuel de chimie ou recherchez en ligne des exercices pratiques. Faites autant que vous le pouvez jusqu`à ce que vous maîtrisiez l`écriture de formules chimiques.
Partie 3 sur 3: Déterminer les produits de réactifs donnés

1. Déterminer tous les cations et anions dans les réactifs. Dans l`équation d`une simple équation de remplacement double, il y a deux cations et anions. L`équation générale est sous la forme AB + CD --> AD + CB, où A et C sont des cations et B et D sont des anions. Déterminez également la charge de chaque ion.
- Par exemple : AgNO3 + NaCl --> ?
- Les cations sont : Ag. Les anions sont : NON3 et Cl.

2. Échangez les ions pour créer les produits. Une fois que vous avez déterminé tous les ions et leurs charges, arrangez-les de sorte que le premier cation soit lié au deuxième anion, et le deuxième cation soit lié au premier anion. Rappelez-vous l`équation : AB + CD --> DA + CB.

3. Écrivez l`équation complète. Après avoir écrit les produits qui se forment dans l`équation, vous pouvez écrire l`équation entière avec à la fois les produits et les réactifs. Placez les réactifs sur le côté gauche de l`équation et écrivez les nouveaux produits sur le côté droit, avec un signe plus entre.

4. Apportez l`équationen équilibre. Une fois que vous avez écrit l`équation et déterminé tous les produits et réactifs, assurez-vous que tout est en équilibre. Une équation n`est en équilibre que lorsqu`il y a le même nombre d`atomes de chaque élément des deux côtés.

5. Entraînez-vous avec quelques exemples. La seule façon de s`améliorer dans l`écriture d`équations est de la pratiquer. Travaillez sur les exemples suivants pour vous assurer que vous comprenez vraiment le processus.
Articles sur le sujet "Faire une équation chimique"
Оцените, пожалуйста статью
Populaire