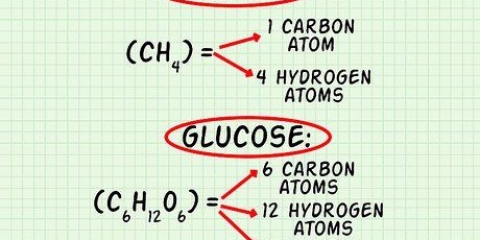
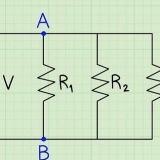
Côté gauche : 3 carbone, 8 hydrogène et 2 oxygène Côté droit : 1 carbone, 2 hydrogène et 3 oxygène Le coefficient 3 pour le carbone à droite signifie 3 carbones, tout comme l`indice 3 à gauche signifie 3 carbones. Dans une équation chimique, vous pouvez modifier les coefficients, mais vous ne devez jamais modifier les indices. À droite, nous avons ajouté 4 comme coefficient, car l`indice montrait que nous avions déjà 2 atomes d`hydrogène. Lorsque vous multipliez le coefficient 4 par l`indice 2, vous obtenez 8. Les atomes de carbone, d`hydrogène et d`oxygène sont en équilibre. Votre équation est prête.
Rendre une équation de réaction correcte
Teneur
Une équation chimique est une représentation théorique ou écrite de ce qui se passe lors d`une réaction chimique. La loi de conservation de la masse dit que les atomes ne peuvent pas être créés ou détruits dans une réaction chimique, donc le nombre d`atomes dans les réactifs doit équilibrer le nombre d`atomes dans les produits. Suivez ce guide pour apprendre à équilibrer les équations chimiques.
Pas
1. Écrivez votre équation donnée. Pour cet exemple, nous utilisons : C3hein8 + ô2 --> hein2O + CO2

2. Notez le nombre d`atomes que vous avez de chaque côté de l`équation. Regardez les indices à côté de chaque atome pour connaître le nombre d`atomes dans l`équation.
3. Gardez toujours l`hydrogène et l`oxygène pour la fin. Cela signifie que vous devez d`abord équilibrer l`atome de carbone. Ajoutez un coefficient à l`atome de carbone unique du côté droit de l`équation, pour l`équilibrer avec les 3 atomes de carbone du côté gauche de l`équation.
C3hein8 + ô2 → H2ô + 3CO2
C3hein8 + ô2 → H2ô + 3CO2
4. Puis équilibrer les atomes d`hydrogène. Vous en avez 8 à gauche, vous devez donc en avoir 8 à droite.
C3hein8 + ô2 → 4hein2O + 3CO2
C3hein8 + ô2 → 4hein2O + 3CO2
5. Enfin, équilibrez les atomes d`oxygène. Depuis que nous avons ajouté des coefficients aux molécules du côté droit de l`équation, le nombre d`atomes d`oxygène a changé. Nous avons maintenant 4 atomes d`oxygène dans la molécule d`eau et 6 atomes d`oxygène dans la molécule de dioxyde de carbone. Cela fait un total de 10 atomes d`oxygène. Ajouter un coefficient de 5 à la molécule d`oxygène sur le côté gauche de l`équation. Vous avez maintenant 10 molécules d`oxygène de chaque côté.
C3hein8 + 5ô2 → 4H2O + 3CO2.
C3hein8 + 5ô2 → 4H2O + 3CO2.
Des astuces
- Si vous êtes bloqué, vous pouvez entrer l`équation dans un programme d`équilibrage en ligne. Gardez à l`esprit que vous ne pouvez pas accéder à un tel programme pendant un examen, alors ne devenez pas dépendant de celui-ci.
Mises en garde
- N`utilisez jamais de fractions comme coefficients dans une équation chimique - vous n`avez jamais la moitié d`une molécule ou la moitié d`un atome dans une réaction chimique. Pour vous débarrasser des fractions, multipliez l`équation entière (à gauche et à droite) par le nombre dans le diviseur de votre fraction.
Articles sur le sujet "Rendre une équation de réaction correcte"
Оцените, пожалуйста статью
Similaire
Populaire