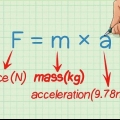Dans l`exemple ci-dessus, supposons que vous mettiez de l`hydrogène et de l`oxygène dans le calorimètre, le scelliez et notiez une température (T1) de 150K (ce qui est très bas). 

Dans l`exemple, supposons que la deuxième température est (T2) ou 95K. 
Dans l`exemple, vous calculez ∆T comme suit :
T = T2 – T1 = 95K – 185K = -90K 
Dans l`exemple ci-dessus, vous utilisez de l`hydrogène et de l`oxygène, qui ont respectivement des masses molaires de 2g et 32g. Puisque vous avez 2 moles d`hydrogène et utilisé 1 mole d`oxygène, vous pouvez calculer la masse totale des réactifs comme suit :
2x(2g) + 1x(32g) = 4g + 32g = 36g 
Dans la formule, m est la masse totale des réactifs ; s est la chaleur spécifique, qui est également constante pour tout élément ou composé. Dans l`exemple ci-dessus, le produit final est de l`eau, avec une chaleur spécifique de 4,2 JK-1 g-1. L`enthalpie de la réaction peut donc être calculée comme suit :
H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J 
Dans l`exemple ci-dessus, la dernière réponse est -13608 J. Il s`agit donc d`une réaction exothermique qui utilise une quantité importante d`énergie.
Détermination de l'enthalpie d'une réaction
Teneur
Chaque fois que vous mélangez des composants chimiques, que ce soit dans la cuisine ou dans un laboratoire de chimie, vous créez de nouvelles substances, ce que nous appelons des « produits ». Au cours de ces réactions chimiques, la chaleur peut être absorbée ou libérée dans l`environnement. L`échange de chaleur lors d`une réaction chimique avec l`environnement est connu sous le nom d`enthalpie d`une réaction, écrit H. Pour trouver ∆H lisez l`article suivant.
Pas

1. Préparer les réactifs pour la réaction chimique. Pour mesurer correctement l`enthalpie d`une réaction, vous devez d`abord avoir la bonne quantité de chaque réactif.
- Par exemple, supposons que vous vouliez trouver l`enthalpie de la réaction dans laquelle l`eau est formée à partir d`hydrogène et d`oxygène : 2H2 (Hydrogène) + O2 (Oxygène)→2H2O (Eau). Pour les besoins de cet exemple, supposons que nous ayons 2 moles d`hydrogène et 1 mole d`oxygène.

2. Nettoyer le réacteur. Pour vous assurer que la réaction se déroule sans contamination, nettoyez le récipient de réaction (généralement un calorimètre) que vous avez l`intention d`utiliser.

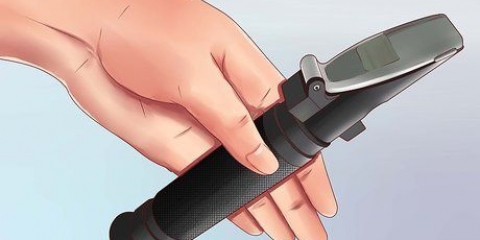
3. Placer un bâtonnet et un thermomètre dans le récipient de réaction. Préparer le mélange selon les besoins et mesurer leur température en tenant à la fois le bâtonnet agitateur et le thermomètre dans le décalorimètre.

4. Verser les réactifs dans le réacteur. Une fois que tout est bien préparé, vous pouvez mettre les réactifs dans le calorimètre. Fermez-le immédiatement après.

5. Mesurer la température. A l`aide du thermomètre placé dans le calorimètre, noter immédiatement la température après avoir ajouté les réactifs.

6. Continuer avec le commentaire. Laisser le temps aux substances de réagir, remuer si nécessaire pour accélérer exactement.

sept. Mesurer à nouveau la température. Lorsque la réaction est terminée, enregistrez à nouveau la température.

8. Calculer la différence de température de T1 et T. Vous écrivez la différence comme ∆T.
T = T2 – T1 = 95K – 185K = -90K

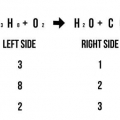
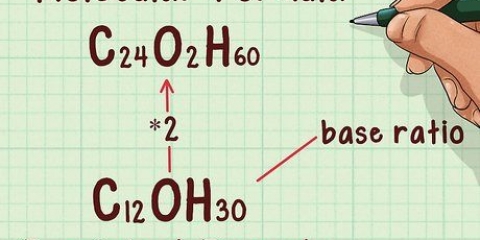
9. Déterminer la masse totale des réactifs. Si vous voulez calculer la masse totale des réactifs, vous avez besoin de la masse molaire de vos composants. La masse molaire est une constante; vous pouvez les trouver dans les tableaux périodiques standard ou d`autres tableaux de chimie.
2x(2g) + 1x(32g) = 4g + 32g = 36g

dix. Calculer l`enthalpie de la réaction. Une fois que vous avez fait cela, vous pouvez déterminer l`enthalpie de la réaction. La formule ressemble à ceci : ∆H = (m) x (s) x ( ∆T)
H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J

11. Notez le résultat. Si le signe de votre réponse est négatif, alors la réaction est exothermique : de la chaleur est perdue dans l`environnement. Si le signe de la réponse est positif, alors la réaction est endothermique : la chaleur est absorbée par l`environnement.
Des astuces
- Ces calculs sont effectués en Kelvin (K) - une échelle de mesure de la température tout comme Celsius. Si vous voulez convertir Kelvin en Celsius, ajoutez simplement 273 degrés : K = C + 273.
Articles sur le sujet "Détermination de l'enthalpie d'une réaction"
Оцените, пожалуйста статью
Similaire
Populaire