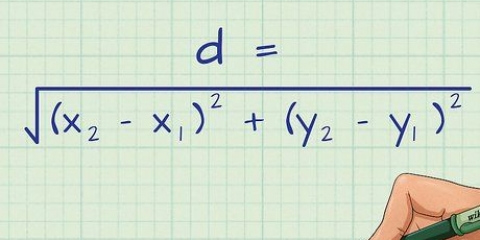Dans cette formule, m le nombre de moles, p la pression, V le volume, t la température en Kelvin et R la constante de gaz. Exemple : n=PV/RT=(0.984 atm x 1 L) / (0.08206 L atm mol-1 K-1 x 318.15 K)=0.0377 mol 
Exemple : 14,42 g / 0,0377 mol = 382,49 g/mol 
Exemple : (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Exemple : 382,49 / 190,366 = 2,009 
Exemple : C12OH30 x 2=C24O2H60 

Exemple: 75,46 g C x (1 mol / 12.0107 g) = 6,28 mol C 8,43 g O x (1 mol / 15,9994 g) = 0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Exemple : La plus petite quantité molaire est l`oxygène avec 0,53 mol. 6,28 mol/0,53 mol=11,83 0,53 mol/0,53 mol=1 15,98 mol/0,53 mol = 30,15 
Exemple : la formule du rapport devient alors C12OH30 11,83=12 1=1 30.15=30 


Détermination de la formule moléculaire d'une substance
Teneur
La formule moléculaire est une information importante sur un produit chimique. La formule moléculaire indique quels atomes sont présents dans la substance et combien de chacun. Vous avez besoin de la formule du rapport pour calculer la formule moléculaire et vous devez également savoir que la différence entre ces deux formules est un nombre entier.
Pas
Partie 1 sur 3: Dériver la formule moléculaire d`une formule de rapport

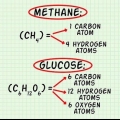
1. Connaître la relation entre la formule moléculaire et la formule du rapport. La formule du rapport dit quelque chose sur le rapport des atomes dans une molécule, par exemple, deux atomes d`oxygène sur chaque atome de carbone. La formule moléculaire vous indique combien de chacun de ces atomes est présent dans la molécule. Par exemple, un carbone et deux atomes d`oxygène (dioxyde de carbone). Ces deux formules se rapportent l`une à l`autre par un nombre entier de telle sorte que si la formule du rapport est multipliée par ce rapport, la formule moléculaire sortira.

2. Calculer le nombre de moles de gaz. Cela signifie que vous utilisez la loi des gaz parfaits. Vous pouvez déterminer le nombre de moles en fonction de la pression, du volume et de la température fournis par les données d`expériences. Le nombre de moles peut être calculé par la formule : n=PV/RT.

3. Calculer la masse moléculaire du gaz. Cela ne peut être fait que lorsque le nombre de moles présentes dans le gaz est connu, en utilisant la loi des gaz parfaits. Vous aurez également besoin de savoir combien de grammes de gaz sont présents. Divisez ensuite le nombre de grammes de gaz par le nombre de moles de gaz présent, pour déterminer la masse moléculaire.

4. Additionner les masses atomiques de tous les atomes dans la formule du rapport. Chaque atome de la formule du rapport a sa propre masse atomique. Cette valeur se trouve au bas de la case de cet élément, dans le tableau périodique. Additionnez ces masses pour obtenir la masse de la formule du rapport.

5. Déterminer le rapport entre la masse moléculaire et celle de la formule du rapport. Cela vous permet de déterminer à quelle fréquence la masse entre dans la molécule réelle selon la formule du rapport. Si vous le savez, vous savez également combien de fois la formule du rapport entre dans la formule moléculaire. Cela devrait être un entier. Si le rapport n`est pas un nombre entier, alors vous devez l`arrondir.

6. Multiplier la formule du rapport par le rapport. Multiplier les indices de la formule du rapport par le rapport. Cela vous donnera la formule moléculaire. Notez que pour toute substance avec un rapport de « 1 », la formule du rapport et la formule moléculaire seront les mêmes.
Partie 2 sur 3: Détermination de la formule du rapport

1. Déterminer la masse de chaque atome présent. Parfois, la masse de chaque atome sera donnée. A un autre moment, seule la masse en pourcentage est donnée. Si tel est le cas, supposez qu`il s`agit d`un échantillon de 100 g de la substance. Avec cela, vous pouvez écrire le pourcentage de masse en tant que masse réelle en grammes.
- Exemple : 75,46 g C, 8,43 g O, 16,11 g H

2. Convertir les masses en nombre de moles. Vous devez convertir la masse moléculaire de chaque élément en mol. Pour ce faire, divisez la masse moléculaire par la masse atomique de chaque élément respectif. Vous pouvez trouver la masse atomique au bas de la boîte de cet élément dans le tableau périodique.

3. Divisez chaque valeur molaire par la plus petite valeur molaire. Vous devez diviser les moles de chaque élément individuel par la plus petite quantité molaire de tous les éléments présents dans le composé. Il vous permet de déterminer les rapports molaires les plus simples. Ceci est valable car l`élément présent en moindre quantité est mis à `1`, et il donne les proportions respectives des autres éléments dans le composé.

4. Arrondir les valeurs molaires à des nombres entiers. Ces nombres deviennent les indices de la formule du rapport. Arrondir au nombre entier le plus proche. Après avoir déterminé ces nombres, vous pouvez écrire la formule du rapport.
Partie 3 sur 3: Comprendre la formule chimique

1. Comprendre le fonctionnement d`une formule de ratio. Une formule de rapport vous donne des informations sur le rapport d`un atome à un autre dans une molécule. Cela ne vous donne aucune information sur le nombre d`atomes exactement présents dans la molécule. La formule du rapport ne vous donne pas non plus d`informations sur la structure et la liaison des atomes dans une molécule.

2. Sachez ce que vous dit une formule moléculaire. Comme la formule du rapport, la formule moléculaire ne vous donne pas d`informations sur la liaison et la structure d`une molécule. Mais contrairement à la formule du rapport, la formule moléculaire vous donne des informations sur la quantité de chaque atome présent dans la molécule. La formule du rapport et la formule moléculaire se rapportent l`une à l`autre selon un rapport entier.

3. Comprendre les formules structurelles. Les formules développées fournissent encore plus d`informations que les formules moléculaires. En plus d`indiquer le nombre d`atomes dans une molécule, les formules structurelles vous donnent également des informations sur les liaisons et la structure de la molécule. Cette information est cruciale pour comprendre comment la molécule va réagir.
Des astuces
- Lisez attentivement la déclaration (ou les données).
Mises en garde
- Ne confondez pas la formule du rapport et la formule moléculaire.
Nécessités
- Tableau périodique des éléments
- Calculatrice
- Crayon
- Papier
Articles sur le sujet "Détermination de la formule moléculaire d'une substance"
Оцените, пожалуйста статью
Similaire
Populaire