Exemple: Supposons que nous ayons besoin de trouver la concentration (en grammes par litre) d`une solution obtenue en dissolvant 1/2 cuillère à café de sel dans 2 litres d`eau. Nous savons aussi que 1 cuillère à café de sel équivaut à environ 6 grammes. Dans ce cas, la conversion est facile - multipliez : 1/2 cuillères à café x (6 grammes/1 cuillère à café) = 3 grammes de sel. 3 grammes de sel divisés par 2 litres d`eau = 1.5g/L Exemple: Supposons que nous voulions trouver la molarité de la solution saline ci-dessus. Pour rappel, nous avons 3 grammes de sel (NaCl) dans 2 litres d`eau. Commencez par connaître les masses molaires de Na et Cl en regardant dans le tableau périodique. Na = environ 23 g/mol et Cl = environ 35,5 g/mol. Donc, le MM de NaCl = 23 + 35,5 = 58,5 g/mol. 3 grammes de NaCl x (1 mol NaCl/58,5 g NaCl) = 0,051 mol NaCl. 0,051 mol NaCl / 2 litres d`eau = .026 M NaCl Quelle est la molarité du NaCL dans une solution de 400 ml, obtenue en ajoutant 1.5 grammes de NaCl dans l`eau? Quelle est la concentration, en ppm, d`une solution obtenue en ajoutant 0,001 g de plomb (Pb) à 150 L d`eau? (1 L d`eau = 1000 grammes) Dans ce cas, le volume de la solution augmentera d`une infime quantité en ajoutant la substance, vous pouvez donc utiliser le volume du solvant comme volume de la solution. Trouvez la concentration en grammes par litre d`une solution de 0,1 L obtenue en ajoutant 1/2 mole de KCl à de l`eau. Ce problème vous oblige à travailler d`avant en arrière, en utilisant la masse molaire de KCL pour calculer les grammes de KCl dans le soluté. Assurez-vous que tout l`équipement est pré-nettoyé, rincé à l`eau déminéralisée et sec. Faites attention: si la réaction entre la solution dans la burette et le soluté dans le ballon ne montre aucun signe de réaction, alors vous indicateur faut mettre dans le cul. Ceux-ci sont utilisés en chimie pour donner un signal visuel lorsqu`une solution atteint le point d`équivalence ou le point final. Les indicateurs sont généralement utilisés pour les titrages étudiant les réactions acide-base et redox, mais il existe également plusieurs autres indicateurs. Consultez un manuel de chimie ou Internet pour trouver un indicateur adapté à votre réaction. Si la réaction entraîne un changement de pH ou de potentiel, vous pouvez mettre des lecteurs de pH ou un potentiomètre dans le ballon pour évaluer la progression de la réaction chimique. Pour un titrage plus précis, surveillez le pH ou le potentiel comme indiqué ci-dessus, en notant comment la réaction se déroule à chaque fois après avoir ajouté une petite quantité de titrant. Tracer l`acidité de la solution ou le potentiel contre le volume du titrant ajouté. Vous verrez des changements brusques dans la pente de la courbe aux points d`équivalence de la réaction. Enregistrez le volume final dans votre burette. En soustrayant cela du volume de départ dans la burette, vous pouvez trouver le volume exact du titrant que vous avez utilisé. Par exemple, supposons que nous utilisions 25 ml de NaOH 0,5 M lors du titrage d`une solution de HCl dans l`eau jusqu`au point d`équivalence. La solution de HCl avait un volume de 60 ml pour le titrage. Combien de moles de HCl y a-t-il dans notre solution? Pour commencer, regardons l`équation chimique de la réaction de NaOH et HCl : NaOH + HCl > hein2O + NaCl Dans ce cas, 1 molécule de NaOH réagit avec 1 molécule de HCl pour produire de l`eau et du NaCl. Donc, puisque vous avez ajouté juste assez de NaOH pour neutraliser tout le HCl, le nombre de moles de NaOH consommées dans la réaction sera égal au nombre de moles de HCl dans le ballon. Voyons donc quelle est la quantité de NaOH en mol. 25 ml NaOH = 0,025 L NaOH x (0,5 mol NaOH/1 L) = 0,0125 mole de NaOH. Puisque nous avons déduit de l`équation de réaction que les moles de NaOH consommées dans la réaction = les moles de HCl dans la solution, nous savons maintenant qu`il y a 0,0125 mole de HCl dans la solution. Pour trouver la molarité de l`exemple ci-dessus, divisez les moles de HCl par le volume dans le ballon. 0,0125 mol HCl x (1/0,060 L) = 0,208 M HCl. Pour convertir la molarité en g/L, ppm ou pourcentage de composition, vous devez convertir les moles de votre soluté en masse (en utilisant la masse molaire de votre soluté.) Pour les ppm et le pourcentage de composé, vous devez également convertir le volume de votre solution en masse (en utilisant un facteur de conversion comme la densité, ou simplement en le pesant), puis multiplier le résultat par 10 ou 10, respectivement. 

Titrer le nitrate d`argent d`une burette ou d`une petite aiguille hypodermique dans l`échantillon d`aquarium jusqu`à ce que la solution devienne trouble. Avec un si petit échantillon, il est important de exactement déterminez la quantité de nitrate d`argent que vous avez ajoutée - étudiez attentivement chaque goutte. 
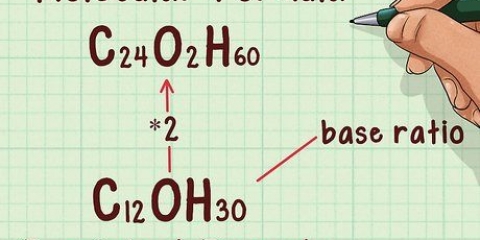
Supposons qu`il y ait 3 ml de 0,25 M AgNO3 était nécessaire pour que la réaction se termine et l`eau ne s`est pas trouble davantage. 3 ml x 0,25 M = 0,003 L x (.25 mol AgNO3/1L) = 0,000075 mol AgNO3. Dans ce cas : 1 mol d`AgNO3 réagit avec 1 mol de NaCl. Mais si 1 mole de titrant réagit avec 2 moles de notre soluté, alors nous multiplierions les moles de notre titrant par 2 pour obtenir les moles de notre soluté. En revanche, si 2 moles de notre titrant réagissent avec 1 mole de notre soluté, alors nous divisons le nombre de moles du titrant par deux. Ces règles correspondent proportionnellement à 3 moles de titrant et 1 mole de soluté, 4 moles de titrant et 1 mole de soluté, etc. ainsi que 1 mole de titrant et 3 moles de soluté, 1 mole de titrant et 4 moles de soluté, etc. MM Na = 22.990. MM Cl = 35.453. 22.990 + 35.453 = 58,443 g/mol 0,000075 mol NaCl x 58,442 g/mol = 0,00438 mole de NaCl. Faites attention: S`il y a plus d`un type de molécule dans un atome, alors vous devez ajouter la masse molaire de cet atome plusieurs fois. Par exemple, si vous prenez la masse molaire de AgNO3, Si vous voulez le trouver, vous devrez ajouter la masse ou l`oxygène trois fois car il y a trois atomes d`oxygène dans la molécule. La salinité de l`eau de mer est d`environ 35 g NaCl/L. Notre aquarium n`est pas assez salé pour les poissons marins.
Détermination de la concentration d'une solution
Teneur
En chimie ou en chimie un Solution un mélange homogène de deux choses -- un substance dissoute et un solvant ou solvant dans lequel la substance est dissoute. Concentration est une mesure de la quantité de soluté dans un solvant. Il peut y avoir de nombreuses raisons pour déterminer la concentration d`une solution, mais la chimie impliquée est la même, que vous testiez le niveau de chlore dans une piscine ou que vous effectuiez une analyse vitale sur un échantillon de sang. Ce guide vous apprendra certaines parties fondamentales de la chimie des solutions, puis vous expliquera la procédure d`une application pratique courante - l`entretien de l`aquarium.
Pas
Partie1 sur 3: Les bases des concentrations
1. Notation des concentrations. La concentration d`une substance est la quantité de ce soluté divisée par la quantité de solvant. Cependant, étant donné qu`il existe différentes manières d`exprimer la quantité d`une substance donnée, il est également possible d`exprimer une concentration de différentes manières. Voici les orthographes les plus courantes :
- Grammes par litre (g/L.) La masse d`un soluté en grammes dissous dans un volume donné d`une solution (qui n`est pas nécessairement le même que le volume du solvant.) Généralement utilisé pour les solutions de solides dans des solvants liquides.
- Molarité (M.) Le nombre de moles d`un soluté divisé par le volume de la solution.
- Parties par million (ppm.) Le rapport du nombre de particules (généralement en grammes) d`un soluté par million de parties d`une solution multiplié par 10. Habituellement utilisé pour une solution très diluée dans l`eau (1 L d`eau = 1000 grammes.)
- Pourcentage de tissu composite. Le rapport des particules (à nouveau en grammes) d`un soluté pour 100 particules d`une solution, exprimé en pourcentage.
2. Connaître les données dont vous avez besoin pour trouver une concentration. Sauf pour la molarité (voir ci-dessous), les orthographes habituelles d`une concentration comme indiqué ci-dessus nécessitent que vous connaissiez la masse du soluté et la masse ou le volume de la solution résultante. De nombreux problèmes de chimie qui nécessitent de trouver la concentration d`une solution ne vous donnent pas cette information. Si tel est le cas, vous devrez travailler avec ce que vous savez pour obtenir cette information.
3. Apprenez à calculer la molarité. La molarité vous oblige à connaître les moles de votre soluté, mais vous pouvez facilement en déduire si vous connaissez la masse du soluté et sa formule chimique. Chaque élément chimique a une valeur connue "masse molaire" (MM) - une masse spécifique pour une mole de cet élément. Ces masses molaires peuvent être trouvées dans le tableau périodique (généralement sous le symbole chimique et le nom de l`élément.) Additionnez simplement les masses molaires des composants du soluté pour calculer la masse molaire. Multipliez ensuite la masse connue du soluté par le (1/MM de votre soluté) pour trouver la quantité de votre soluté en moles.
4. Pratiquez des exercices standards sur le calcul des concentrations. Les connaissances ci-dessus sont tout ce dont vous avez besoin pour calculer les concentrations dans des situations simples. Si vous connaissez la masse ou le volume de la solution et la quantité de soluté initialement ajoutée, ou si vous pouvez la déduire des informations données dans l`exercice, vous devriez pouvoir calculer facilement la concentration d`une solution. Créez des exercices pratiques pour améliorer vos compétences. Voir les exemples de devoirs ci-dessous :
Partie 2 sur 3 : Titrage
1. Comprendre quand appliquer un titrage. Le titrage est une technique utilisée par les chimistes pour calculer la quantité de soluté présent dans une solution. Pour effectuer un titrage, vous fournissez une réaction chimique entre le soluté et un autre réactif (généralement également dissous). Parce que vous connaissez la quantité exacte de votre deuxième réactif et que vous connaissez l`équation chimique de la réaction entre le réactif et le soluté, vous pouvez calculer la quantité de votre soluté en mesurant la quantité de réactif dont vous avez besoin pour la réaction avec le soluté. Achevée.
- Ainsi, les titrages peuvent être très utiles lors du calcul de la concentration d`une solution si vous ne savez pas combien de soluté a été ajouté en principe.
- Si vous savez combien de soluté est présent dans la solution, alors il n`est pas nécessaire de titrer - il suffit de mesurer le volume de votre solution et de calculer la concentration, comme décrit dans la partie 1.
2. Configurez votre équipement de titrage. Pour effectuer des titrages précis, vous avez besoin d`un équipement propre, précis et professionnel. Utiliser une fiole Erlenmeyer ou un bécher sous une burette calibrée, fixée sur un porte-burette. Le bec de la burette doit s`insérer dans le col du flacon ou du bécher sans toucher les parois.
3. Remplir le flacon et la burette. Mesurer avec précision une petite quantité de la solution inconnue. Lorsque la substance est dissoute, elle se disperse uniformément dans tout le solvant, de sorte que la concentration de ce petit échantillon de la solution sera la même que celle de la solution d`origine. Remplissez votre burette avec une solution de concentration connue qui réagira avec votre solution. Notez le volume exact de solution dans la burette - soustrayez le volume final pour trouver la solution totale utilisée dans la réaction.
4. Commencer par le titrage. Ajouter progressivement une solution de la burette (de "titrant") dans le flacon. Utilisez un agitateur magnétique ou un agitateur en verre pour mélanger doucement la solution pendant que la réaction est en cours. Si votre solution réagit visiblement, vous devriez voir certains signes qu`une réaction est en cours - changement de couleur, bulles, résidus, etc. Si vous utilisez un indicateur, vous pouvez voir un changement de couleur à chaque goutte qui se retrouve dans le flacon à travers la burette.
5. Ralentissez votre titrage. Au fur et à mesure que votre réaction chimique approche du point final, ralentissez le titrage jusqu`à ce qu`il progresse goutte à goutte. Si vous utilisez un indicateur, vous remarquerez peut-être que la couleur clignote plus longtemps. Continuez maintenant à titrer aussi lentement que possible jusqu`à ce que vous puissiez déterminer la goutte exacte qui amène votre réaction à atteindre le point final. Dans le cas d`un indicateur, vous recherchez généralement le changement de couleur soutenu le plus tôt possible dans la réaction.
6. Calculez la quantité de soluté dans votre solution. Utilisez l`équation chimique de la réaction entre votre titrant et la solution pour trouver les moles de soluté dans votre flacon. Une fois que vous avez trouvé les moles de soluté, vous pouvez simplement diviser par le volume de la solution dans le ballon pour trouver la molarité de la solution, ou convertir les moles en grammes et diviser par le volume de la solution, pour obtenir le concentration en g/L. Cela nécessite un peu de connaissances de base en stoechiométrie.
sept. Calculez la concentration de votre solution. Maintenant que vous connaissez la quantité de soluté dans votre solution, il est facile de trouver la concentration en termes de molarité. Divisez simplement les moles de soluté dans votre solution par le volume de votre échantillon de solution (ne pas le volume de la plus grande quantité que vous avez échantillonnée.) Le résultat est la molarité de votre solution!
Partie 3 sur 3: Détermination de la salinité dans un aquarium

1. Prélevez un échantillon d`eau de votre aquarium. Enregistrez le volume avec précision. Si possible, mesurez le volume en unités SI telles que ml - elles sont faciles à convertir en L.
- Dans cet exemple, nous testons la salinité de l`eau de l`aquarium, la concentration de sel (NaCl) dans l`eau. Supposons que nous prélevions un échantillon d`eau à cette fin à partir de 3mL de l`aquarium, puis définissez la réponse finale à donner dans g/l.

2. Titrer l`échantillon d`eau. Choisissez un titrant qui produit une réaction clairement visible dans le soluté. Dans ce cas, nous utilisons une solution de 0,25 M AgNO3 (nitrate d`argent), un composé qui produit un sel de chlore insoluble lorsqu`il réagit avec NaCl dans la réaction suivante : AgNO3 + NaCl > NaNO3 + AgCl. Le sel (AgCl) sera visible sous la forme d`un résidu blanc trouble qui flottera et peut être séparé de la solution.

3. Continuez jusqu`à ce que le commentaire s`arrête. Lorsque le nitrate d`argent cesse de troubler la solution, vous pouvez enregistrer le nombre de ml ajouté. Titrer l`AgNO3 très lent et observez attentivement la solution, surtout à l`approche du point final.
4. Déterminer le nombre de moles du titrant. Cette étape est facile - multipliez le volume de titrant que vous avez ajouté par la molarité. Cela vous donnera le nombre de moles de titrant utilisé.
5. Déterminez le nombre de moles de votre soluté. Utilisez l`équation de réaction pour la conversion du nombre de moles d`AgNO3 en moles de NaCl. L`équation de la réaction est : AgNO3 + NaCl > NaNO3 + AgCl. Parce que 1 mole d`AgNO3 réagit avec 1 mole de NaCl, nous savons maintenant que le nombre de moles de NaCl dans notre solution = le nombre de moles d`AgNO3 qui a été ajouté : 0,000075 mole.
6. Convertissez votre nombre de moles de soluté en grammes. Pour ce faire, vous devrez calculer la masse molaire du soluté et la multiplier par le nombre de moles de votre soluté. Pour trouver la masse molaire de NaCl, utilisez le tableau périodique pour trouver et additionner les poids atomiques du sel (Na) et du chlorure (Cl).
sept. Calculer la concentration finale. Nous avons la masse de notre soluté en grammes et nous connaissons le volume de la solution à tester. Il ne nous reste plus qu`à diviser : 0,00438 g NaCl/0,003 L = 1,46 g NaCl/L
Des astuces
- Bien que le soluté et le solvant puissent exister dans des états différents (solide, liquide ou gazeux) s`ils sont séparés, la solution formée lorsque la substance se dissout sera dans le même état que l`état du solvant.
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- Utilisez uniquement du plastique transparent ou du verre.
- Voici un exemple de vidéo :[1]
Mises en garde
- Conservez la solution AgNO3 dans un flacon sombre fermé. Il est sensible à la lumière.
- Soyez prudent lorsque vous travaillez avec des acides ou des bases fortes. Assurez-vous qu`il y a suffisamment d`air frais dans la pièce.
- Portez des lunettes de sécurité et des gants.
- Si vous souhaitez récupérer l`argent, veuillez noter ce qui suit : Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 + 2 Ag (s) N`oubliez pas que (s) signifie solide.
Articles sur le sujet "Détermination de la concentration d'une solution"
Оцените, пожалуйста статью
Similaire
Populaire