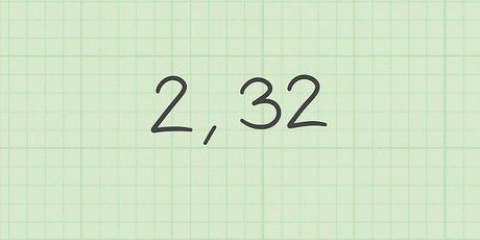Exemple de devoir : Mol = 0,75 mole de NaCl Volume = 4,2 L 
Exemple de problème : molarité = 0,75 mol / 4.2L = 0,17857142 
Exemple de devoir : 0,179 M de NaCl 

Exemple de devoir : Masse = 3,4 g de KMnO4 Volume = 5,2 L 
Exemple de devoir : La masse molaire de K = 39,1 g La masse molaire de Mn = 54,9 g La masse molaire de O = 16,0 g Masse molaire totale = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 grammes 
Exemple de problème : grammes de substance * (1/masse molaire de la substance) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Exemple de problème : molarité = 0,0215 mol / 5.2L = 0.004134615 
Exemple de devoir : 0,004 millions de KMnO4 

Exemple de devoir : Nombre de moles = 1,2 mole de CaCl2 Contenance = 2905 ml 
Exemple d`énoncé : 2905 ml * (1 L / 1000 ml) = 2905 L 
Exemple d`affectation : 1,2 mol de CaCl2 / 2905L = 0,413080895 
Exemple de devoir : 0,413 M CaCl2 

La masse molaire de Na = 22,99 g La masse molaire de Cl = 35,45 g La masse molaire de NaCl = 22,99 + 35.45 = 58,44 grammes 
Mole NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Vous pouvez également voir cela en multipliant 800 ml par un facteur de conversion de 1 L / 1000 ml. Pour le faire rapidement, il suffit de déplacer la virgule décimale de 3 chiffres vers la gauche, au lieu de calculer cela. Volume = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molarité = nombre de moles de substance / nombre de litres de solution = 0,09 mol / 0,8 L = 0,1125 mol/L 
Réponse: 0,11 M de NaCl
Calcul de la molarité d'une solution
Teneur
La molarité est une description de la relation entre le nombre de moles d`un liquide et son volume. Pour calculer la molarité, vous commencez par les moles et le volume, la masse et le volume ou les moles et les millilitres. Ces variables sont ensuite renseignées dans la formule de calcul de molarité standard pour (espérons-le) obtenir la bonne réponse.
Pas
Méthode 1 sur 4: Calcul de la molarité à l`aide des moles et du volume

1. Apprenez la formule standard pour calculer la molarité. La molarité est égale au nombre de moles d`un soluté divisé par le volume de la solution en litres. C`est déjà écrit : molarité = nombre de moles de substance / nombre de litres de solution
- Exemple de devoir : quelle est la molarité d`une solution de 0,75 mol de NaCl dans 4,2 litres d`eau?

2. Voir le devoir. Le calcul de la molarité nécessite un certain nombre de moles de substance et un certain nombre de litres de solution. Si la déclaration prévoit ces chiffres, aucun travail préparatoire n`est nécessaire.

3. Diviser le nombre de moles par le nombre de litres. La fraction que vous obtenez donne alors le nombre de moles par litre de solution, également connu sous le nom de molarité.

4. Ecrivez votre réponse. Complétez correctement la réponse, en fonction de vos données de mesure et des exigences du problème. Bref le mot "molarité" avec "m" et utilisez le nom chimique du soluté.
Méthode 2 sur 4: Calcul de la molarité avec masse et volume

1. Vous connaissez la formule standard pour calculer la molarité.molarité = nombre de moles de substance / nombre de litres de solution
- Exemple de problème : Quelle est la molarité d`une solution en dissolvant 3,4 g de KMnO4 dans 5,2 litres d`eau?

2. Voir le devoir. Le calcul de la molarité nécessite un certain nombre de moles de substance et un certain nombre de litres de solution. Si le relevé ne fournit pas ces chiffres, un travail préliminaire doit être effectué avant de pouvoir continuer.

3. Déterminer la masse molaire du soluté. Pour trouver les moles du soluté, il faut d`abord calculer la masse molaire. Vous faites cela en additionnant les différentes masses molaires de chaque élément de la substance. Cette masse molaire peut être trouvée en utilisant le tableau périodique.

4. Conversion grammes en moles. Maintenant que vous connaissez la masse molaire du soluté, il faut encore la convertir en nombre de mol. Pour ce faire, déterminez le poids d`une mole de la substance, puis multipliez-le par la masse molaire.

5. Divisez le nombre de moles par le nombre de litres de solution pour trouver la molarité.

6. Ecrivez votre réponse. Complétez correctement la réponse, en fonction de vos données de mesure et des exigences du problème. Bref le mot "molarité" avec "m" et utilisez le nom chimique du soluté.
Méthode 3 sur 4: Calcul de la molarité à l`aide de moles et de millilitres

1. Vous connaissez la formule standard pour calculer la molarité.molarité = nombre de moles de substance / nombre de litres de solution. Si le volume est donné en millilitres, vous devrez le convertir.
- Exemple de problème : quelle est la molarité d`une solution de 1,2 mol de CaCl2 dans 2905 millilitres d`eau?

2. Voir le devoir. Le calcul de la molarité nécessite un certain nombre de moles de substance et un certain nombre de litres de solution. Si le relevé ne fournit pas ces chiffres, un travail préliminaire doit être effectué avant de pouvoir continuer.

3. Convertir le nombre de millilitres en litres. Trouvez le nombre de litres de la solution en divisant le volume par 1000, ou en déplaçant la virgule décimale de 3 chiffres vers la gauche.

4. Diviser le nombre de moles par le nombre de litres. Maintenant que vous avez tous les nombres dans une rangée, vous pouvez calculer la molarité de la solution.

5. Ecrivez votre réponse. Complétez correctement la réponse, en fonction de vos données de mesure et des exigences du problème. Bref le mot "molarité" avec "m" et utilisez le nom chimique du soluté.
Méthode 4 sur 4: Problème de pratique supplémentaire

1. On veut déterminer la molarité d`une solution de 5,2 g de NaCl dans 800 ml d`eau. Énumérez d`abord ces valeurs pour plus de clarté : masse en grammes et volume en millilitres.
- Masse = 5,2 g NaCl
- Volume = 800 ml d`eau

2. Déterminer la masse molaire de NaCl. Vous faites cela en ajoutant la masse molaire de sodium (Na) et la masse molaire de chlore (Cl).

3. Multiplier la masse de la substance par le facteur de conversion de la masse molaire. Dans cet exemple, la masse molaire de NaCl est de 58.44 g, donc vous avez 1 mole / 58,44 g.

4. Divisez 800 ml d`eau par 1000 pour obtenir le nombre de litres.

5. Diviser les moles d`une substance par les litres de solution. Pour trouver la molarité, divisez 0,09 mol de la substance NaCl par 0,8 L de la solution.

6. Rendez votre réponse plus claire. Arrondissez votre réponse à deux ou trois décimales et abrégez la molarité en « M."
Articles sur le sujet "Calcul de la molarité d'une solution"
Оцените, пожалуйста статью
Similaire
Populaire