S`il y a des nombres à côté des réactifs, ce sont les coefficients. Ceux-ci représentent le rapport dans lequel les réactifs sont incorporés. Le réactif limitant est la matière première qui s`épuisera en premier. Dans les réactions avec plusieurs matières premières, la réaction s`arrêtera dès qu`une des matières premières est épuisée, à moins que toutes les matières premières soient reprises dans la même proportion. 
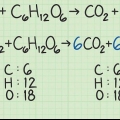
Pour calculer la masse molaire d`une molécule, vous additionnez les masses atomiques de chaque atome de la substance. La masse atomique est le nombre sous le symbole chimique dans le tableau périodique. Rappelez-vous que tous les numéros d`indice d`une molécule signifient que ces atomes sont plus fréquents. 
Si le rapport réel est supérieur à la stoechiométrie, alors le réactif au numérateur est le plus grand, ce qui signifie que l`autre réactif est le facteur limitant. Si le rapport réel est inférieur à la stoechiométrie, alors le réactif dans le numérateur n`est que le facteur limitant. 
Vous calculez le nombre de moles d`une substance produite par des réactifs donnés, en multipliant le nombre de moles d`un réactif par le rapport coefficient produit/coefficient du réactif. Faites ceci pour chaque réactif. 







Calculer le rendement de la réaction
Teneur
En chimie, le rendement de la réaction si ça efficacité de réaction la quantité de substance produite par une réaction chimique. Ce rendement théorique est la quantité maximale de substance qui peut être produite dans une réaction parfaitement efficace. En réalité, la plupart des réactions sont loin d`être parfaites - l`efficacité d`une réaction est généralement inférieure à ce qui est théoriquement possible. Pour exprimer l`efficacité d`une réaction, calculez l`efficacité de la réaction avec la formule : % de rendement = (rendement réel/rendement théorique) x 100.
Pas
Partie 1 sur 3: Déterminer le réactif limitant

1. Commencer à écrire l`équation chimique. Cela servira de représentation mathématique de la réaction finale.
- Si vous ne savez pas comment écrire une équation chimique, consultez le wikiHow sur ce sujet.

2. Déterminez à quels réactifs vous avez affaire. Ceux-ci sont généralement à gauche de la flèche dans l`équation. Ceux-ci sont également désignés par le terme "matières premières." Il est possible (comme dans la partie 2) qu`il n`y ait qu`un seul réactif.

3. Calculer la quantité (en moles) de chaque réactif. Pour ce faire, divisez la masse de chaque réactif par sa masse molaire.

4. Si vous avez deux réactifs, comparez le rapport des moles à celui des coefficients. Ces rapports sont appelés respectivement "rapport réel" et "rapport stoechiométrique."

5. Si vous avez plus de deux réactifs, vous devrez calculer combien de moles de chaque réactif produira une fois la réaction terminée. Le réactif qui produit la plus faible quantité est le facteur limitant.
Partie 2 sur 3: Calcul du rendement théorique

1. Déterminer quel devrait être le produit d`une réaction. C`est généralement sur le côté droit de la flèche dans une formule chimique. Dans cet exemple, CaO est la substance désirée (CO2 est un gaz). Le rendement théorique est une mesure de la quantité de produit que nous attendons si la réaction est pleinement efficace.
- Par exemple: Clair fait 0,45 g de nitrate d`ammonium. Elle prédit un rendement théorique de 0,50g. Quel est le pourcentage de rendement?
- 0,45/0,50 = 0,9. Multipliez cela par 100 pour le pourcentage.
- Pourcentage de rendement = 90 %. Notez la masse de chacune de vos substances de départ.

2. Convertir la masse du réactif limitant en nombre de moles. Pour ce faire, en divisant la masse du réactif par la masse molaire, comme à l`étape 3, divisez 1.

3. Le rapport expérimental. Divisez les moles du produit souhaité par les moles du réactif limitant. C`est ce qu`on appelle le rapport expérimental.

4. Calculer la masse molaire de 1 mole du produit. Enregistrez ce rapport dans l`équation, comme décrit ci-dessous.

5. Prédire le rendement théorique. Multiplier le nombre de moles de réactif limitant par le rapport (coefficient de produit / coefficient de réactif limitant) et multiplier par la masse molaire du produit. Cela vous donne la masse du produit que vous allez produire, si la réaction est parfaitement efficace (selon le rendement théorique).
Partie3 sur 3: Calcul du pourcentage de rendement

1. Laissez la réaction avoir lieu. Recueillez le produit purifié de votre réaction et calculez sa masse sur une balance. Notez la masse.

2. Convertir la masse du produit en moles en divisant par le poids moléculaire. Pour ce faire, procédez de la même manière qu`à l`étape 2, partie 2. Enregistrez le nombre de moles de la substance obtenue au cours de l`expérience en tant que rendement réel.

3. Calculer le pourcentage de rendement. Divisez le rendement réel par le rendement théorique et multipliez par 100. La réponse est un pourcentage, qui compare la masse du produit à la masse d`une réaction idéale (parfaite).
Mises en garde
- Il est possible de calculer un pourcentage de rendement supérieur à 100 %, sans se tromper dans votre calcul. Si le produit final que vous pesez n`est pas pur (il contient des substances qui n`ont pas été prises en compte dans la comparaison chimique), alors le résultat ne sera pas correct.
- C`est pourquoi il est important de purifier avec précision votre produit par filtration, séchage, distillation ou d`une autre manière, en fonction des propriétés de la substance du produit.
Articles sur le sujet "Calculer le rendement de la réaction"
Оцените, пожалуйста статью
Populaire