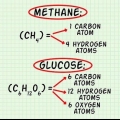
Dans cet exemple, une molécule d`oxygène contient ( ) deux atomes d`oxygène.
) deux atomes d`oxygène. La masse molaire d`un atome d`oxygène est d`environ 16 g/mol. Si nécessaire, vous pouvez calculer des valeurs plus précises. 2 atomes d`oxygène x 16 g/mol par atome = 32 g/mol  .
. L`autre réactif, le glucose ( ) a une masse molaire de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) a une masse molaire de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol. Si vous voulez voir cette étape plus en détail, lisez Calcul de la masse molaire. 
Par exemple, supposons que vous commenciez avec 40 grammes d`oxygène et 25 grammes de glucose. 40g  / (32 g/mol) = 1,25 mol d`oxygène.
/ (32 g/mol) = 1,25 mol d`oxygène. 25g  / (180 g/mol) = environ 0,139 mol de glucose.
/ (180 g/mol) = environ 0,139 mol de glucose. 
Dans l`exemple suivant, vous commencez avec 1,25 mole d`oxygène et 0,139 mole de glucose. Ainsi, le rapport des molécules d`oxygène et de glucose est de 1,25/0,139 = 9,0. Ce rapport signifie que vous avez neuf fois plus de molécules d`oxygène que de glucose. 
Pour cette réaction, les réactifs sont donnés comme  . Les coefficients indiquent que vous avez besoin de six molécules d`oxygène pour chaque molécule de glucose. Le rapport idéal pour cette réaction est 6 oxygène / 1 glucose = 6,0.
. Les coefficients indiquent que vous avez besoin de six molécules d`oxygène pour chaque molécule de glucose. Le rapport idéal pour cette réaction est 6 oxygène / 1 glucose = 6,0. 
Dans l`exemple suivant, vous commencez avec neuf fois plus d`oxygène que de glucose, mesuré par le nombre de moles. La formule vous dit que votre rapport idéal est six fois plus d`oxygène que de glucose. Vous avez donc besoin de plus d`oxygène que de glucose. Donc l`autre réactif, le glucose dans ce cas, est le réactif limitant. 

Dans l`exemple ci-dessus, le glucose est le réactif limitant. Selon les calculs de masse molaire, les 25 premiers g de glucose sont égaux à 0,139 mol de glucose. 
La réaction d`équilibre pour cet exemple est  →
→  . Cette équation vous indique que vous pouvez vous attendre à six molécules du produit souhaité, le dioxyde de carbone (
. Cette équation vous indique que vous pouvez vous attendre à six molécules du produit souhaité, le dioxyde de carbone ( ), et une molécule de glucose (
), et une molécule de glucose ( ).
). Le rapport entre le dioxyde de carbone et le glucose est 6/1 = 6. En d`autres termes, cette réaction peut produire six molécules de dioxyde de carbone à partir d`une molécule de glucose. 
Dans cet exemple, les 25 g de glucose sont égaux à 0,139 mole de glucose. Le rapport entre le dioxyde de carbone et le glucose est de 6:1. Vous vous attendez à pouvoir produire six fois plus de moles de dioxyde de carbone que les moles de glucose avec lesquelles vous avez commencé. Le rendement théorique en dioxyde de carbone est (0,139 mol de glucose) x (6 mol de dioxyde de carbone/mol de glucose) = 0,834 mol de dioxyde de carbone. 
Dans l`exemple suivant, la masse molaire de CO est2 environ 44 g/mol. (La masse molaire du carbone est de ~12 g/mol et celle de l`oxygène de ~16 g/mol, donc le total est de 12 + 16 + 16 = 44). Multiplier 0,834 mol de CO2 x 44 g/mole de CO2 = ~36,7 grammes. Le rendement théorique de l`expérience est de 36,7 grammes de CO2. 
Dans cet exemple, l`eau est le deuxième produit  . Selon la réaction d`équilibre, vous pouvez vous attendre à six molécules d`eau à partir d`une molécule de glucose. C`est un rapport de 6:1. Donc 0,139 mole de glucose devrait donner 0,834 mole d`eau.
. Selon la réaction d`équilibre, vous pouvez vous attendre à six molécules d`eau à partir d`une molécule de glucose. C`est un rapport de 6:1. Donc 0,139 mole de glucose devrait donner 0,834 mole d`eau. Multiplier les moles d`eau par la masse molaire d`eau. La masse molaire est 2 + 16 = 18 g/mol. Multiplié par le produit, cela donne 0,139 mol H2O x 18 g/mol H2O = ~2,50 grammes. Le rendement théorique en eau dans cette expérience est de 2,50 grammes.
Calcul du rendement théorique
Teneur
Le rendement théorique est un terme utilisé en chimie pour la quantité maximale d`une substance obtenue que vous attendez d`une réaction chimique. Vous commencez par équilibrer une équation de réaction et définir le réactif limitant. Lorsque vous mesurez la quantité de réactif que vous souhaitez utiliser, vous pouvez calculer la quantité d`une substance obtenue. C`est le rendement théorique de l`équation. Dans une expérience réelle, vous en perdrez probablement une partie car ce n`est pas une expérience idéale.
Pas
Partie 1 sur 2: Détermination du réactif limitant

1. Commencer par une réaction d`équilibre. Une équation de réaction ressemble à une recette. Il montre quels réactifs (à gauche) réagissent les uns avec les autres pour produire des produits (à droite). Une réaction d`équilibre aura le même nombre d`atomes du côté gauche de l`équation (en tant que réactifs) que du côté droit (sous forme de produits).
- Par exemple, supposons que nous ayons l`équation simple
→
. Il y a deux atomes d`hydrogène à gauche et à droite. Mais il y a deux atomes d`oxygène comme réactif à gauche et un seul atome comme produit à droite.
- Pour équilibrer l`équation, on double le produit, et on obtient
→
.
- Vérifier le solde. Ce changement a fait battre l`oxygène, car il a maintenant deux atomes des deux côtés. Mais vous avez maintenant deux atomes d`hydrogène à gauche avec quatre atomes d`hydrogène à droite.
- Doubler l`hydrogène dans le réactif. Cela rend l`équation
→
. Ce changement a maintenant entraîné quatre atomes d`hydrogène et deux atomes d`oxygène de chaque côté. L`équation est en équilibre.
- Un exemple plus compliqué : l`oxygène et le glucose peuvent réagir pour former du dioxyde de carbone et de l`eau :
→
Dans cette équation, chaque côté a exactement 6 atomes de carbone (C), 12 atomes d`hydrogène (H) et 18 atomes d`oxygène (O). L`équation est en équilibre. - Lire cet article si vous voulez vérifier les équations de réaction de manière plus approfondie.

2. Calculer la masse molaire de chaque réaction. À l`aide du tableau périodique ou d`un autre ouvrage de référence, trouvez la masse molaire de chaque atome dans chaque composé. Additionnez-les pour trouver la masse molaire de chaque composé de réactifs. Faites ceci pour une seule molécule de la composition. Jetez un autre regard sur l`équation de la conversion de l`oxygène et du glucose en dioxyde de carbone et en eau :  →
→ 
 →
→ 
 ) deux atomes d`oxygène.
) deux atomes d`oxygène. .
. ) a une masse molaire de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
) a une masse molaire de (6 C x 12 g C/mol) + (12 H x 1 g H/mol) + (6 O x 16 g O/mol) = 180 g/mol.
3. Convertir la quantité de chaque réactif de grammes en mol. Pour une expérience réelle, la masse en grammes de chaque réactif que vous utilisez sera connue. Divisez cette valeur par la masse molaire de cette substance en tant que conversion en nombre de mol.
 / (32 g/mol) = 1,25 mol d`oxygène.
/ (32 g/mol) = 1,25 mol d`oxygène. / (180 g/mol) = environ 0,139 mol de glucose.
/ (180 g/mol) = environ 0,139 mol de glucose.
4. Déterminer le rapport molaire des réactifs. Une taupe est un outil de calcul utilisé en chimie pour compter les molécules en fonction de leur masse. En déterminant les moles d`oxygène et de glucose, vous savez avec combien de molécules de chacun vous commencez. Pour trouver le rapport des deux, divisez les moles d`un réactif par l`autre.

5. Déterminer le rapport idéal pour la réaction. Regardez la réaction d`équilibre. Les coefficients pour chaque molécule vous indiquent le rapport des molécules dont vous avez besoin pour que la réaction se produise. Si vous utilisez exactement le rapport donné par la formule, les deux réactifs doivent être utilisés de manière égale.
 . Les coefficients indiquent que vous avez besoin de six molécules d`oxygène pour chaque molécule de glucose. Le rapport idéal pour cette réaction est 6 oxygène / 1 glucose = 6,0.
. Les coefficients indiquent que vous avez besoin de six molécules d`oxygène pour chaque molécule de glucose. Le rapport idéal pour cette réaction est 6 oxygène / 1 glucose = 6,0.
6. Comparez les ratios pour trouver le réactif limitant. Dans la plupart des réactions chimiques, l`un des réactifs sera épuisé plus tôt que l`autre. Le réactif utilisé en premier est appelé réactif limitant. Ce réactif limitant détermine combien de temps la réaction chimique peut continuer et le rendement théorique auquel vous pouvez vous attendre. Comparez les deux ratios que vous avez calculés pour déterminer le réactif limitant :
Partie 2 sur 2: Détermination du rendement théorique

1. Voir le commentaire pour trouver le produit désiré. Le côté droit d`une équation chimique montre les produits que la réaction produit. Si la réaction est équilibrée, les coefficients de chaque produit indiquent à combien de chaque rapport moléculaire s`attendre. Chaque produit a un rendement théorique, ou la quantité de produit que vous attendez lorsque la réaction est complètement terminée.
- En continuant l`exemple ci-dessus, vous analysez la réaction
→
. Les deux produits à droite sont le dioxyde de carbone et l`eau.
- Vous pouvez commencer avec l`un ou l`autre produit si vous souhaitez calculer le rendement théorique. Dans certains cas, il est possible que vous ne soyez intéressé que par l`un des deux produits. Si oui, c`est par celui-ci que tu vas commencer.

2. Notez les moles de votre réactif limitant. Vous devez toujours comparer le nombre de moles de réactif limitant avec le nombre de moles d`un produit. Si vous essayez de comparer la masse de chacun, vous n`obtiendrez pas le bon résultat.

3. Comparer le rapport entre les molécules du produit et le réactif. Retour à la réaction d`équilibre. Divisez le nombre de molécules de votre produit souhaité par le nombre de molécules de votre réactif limitant.
 →
→  . Cette équation vous indique que vous pouvez vous attendre à six molécules du produit souhaité, le dioxyde de carbone (
. Cette équation vous indique que vous pouvez vous attendre à six molécules du produit souhaité, le dioxyde de carbone ( ), et une molécule de glucose (
), et une molécule de glucose ( ).
).
4. Multiplier ce rapport par le nombre de moles de réactif limitant. La réponse est le rendement théorique, en moles, du produit recherché.

5. Convertir le résultat en grammes. C`est l`inverse de votre étape précédente de calcul du nombre de moles ou de la quantité de réactif. Si vous connaissez le nombre de moles à prévoir, multipliez-le par la masse molaire du produit pour déterminer le rendement théorique en grammes.

6. Répétez le calcul pour l`autre produit, si désiré. Dans de nombreuses expériences, vous pouvez uniquement vous intéresser à l`efficacité d`un certain produit. Si vous voulez connaître le rendement théorique des deux produits, il vous suffit de répéter le processus.
 . Selon la réaction d`équilibre, vous pouvez vous attendre à six molécules d`eau à partir d`une molécule de glucose. C`est un rapport de 6:1. Donc 0,139 mole de glucose devrait donner 0,834 mole d`eau.
. Selon la réaction d`équilibre, vous pouvez vous attendre à six molécules d`eau à partir d`une molécule de glucose. C`est un rapport de 6:1. Donc 0,139 mole de glucose devrait donner 0,834 mole d`eau.Articles sur le sujet "Calcul du rendement théorique"
Оцените, пожалуйста статью
Populaire