Les atomes sont trop petits pour des mesures significatives de produits chimiques. Afin de pouvoir travailler avec de très petites quantités d`une certaine substance, celles-ci sont classées par les scientifiques en unités de mol. Une mole est définie comme une certaine quantité de substance avec autant de particules que le nombre d`atomes de carbone dans 12 grammes de l`isotope C-12, ce qui équivaut à environ 6,022 14 × 10. C`est ce qu`on appelle le nombre ou la constante d`Avogadro. Il est utilisé pour indiquer le nombre d`atomes, de molécules, d`ions ou de particules subatomiques dans n`importe quelle substance, et la masse de 1 mole est la masse molaire de cette substance. Ici, vous pouvez lire comment calculer la masse molaire des éléments et des substances.
Pas
Méthode 1 sur 2: Calcul de la masse molaire d`un élément
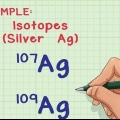
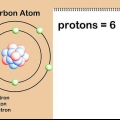
1. Trouver la masse atomique relative de l`élément. La masse atomique relative d`un élément est la moyenne pondérée, exprimée en unités de masse atomique (u), des masses atomiques de tous les isotopes naturels.Vous pouvez trouver ces informations dans le tableau périodique. A titre d`exemple, l`hydrogène a une masse atomique relative de 1,008 ; carbone 12.0107; oxygène 15,9994; et chlore 35.453.
2. Multiplier par la masse molaire. Ceci est défini comme 1 gramme par mol. Cela convertit l`unité de masse atomique en grammes par mole, ce qui rend la masse molaire d`hydrogène égale à 1,008 gramme par mole, le carbone 12,0107 grammes par mole, l`oxygène 15,9994 grammes par mole et le chlore 35,453 grammes par mole.
3. Trouver la masse molaire d`une molécule divalente. Certains éléments ne peuvent être trouvés que dans des molécules de 2 ou plus. Cela signifie que, si vous souhaitez calculer la masse molaire d`un élément composé, par exemple, de 2 atomes, tels que l`hydrogène, l`oxygène et le chlore, déterminez la masse atomique relative et multipliez-la par la masse molaire, puis multipliez le résultat par 2.
Ainsi, la masse molaire d`un élément est égale à la masse molaire d`un atome multipliée par le nombre d`atomes de chaque molécule : pour l`hydrogène, 1,008 fois 2, soit 2,016 grammes par mole ; oxygène, 15,9994 fois 2, ou 31,9988 grammes par mole; et pour le chlore, 35,453 fois 2, soit 70,096 grammes par mole.Méthode 2 sur 2: Calcul de la masse molaire d`un composé
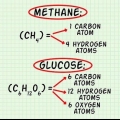
1. Déterminer la formule chimique du composé. C`est le nombre d`atomes dans chaque élément du composé. (Des informations à ce sujet peuvent être trouvées, par exemple, dans les Binas) Par exemple : la formule du chlorure d`hydrogène (acide chlorhydrique) est HCl ; pour le glucose C6hein12ô6. La dernière formule signifie que le glucose contient 6 atomes de carbone, 12 atomes d`hydrogène et 6 atomes d`oxygène.
2. Déterminer la masse molaire de chaque élément du composé. Multiplier la masse atomique de l`élément par la masse molaire et le nombre d`atomes de l`élément dans le composé. Voici comment cela fonctionne :
La masse molaire de chaque élément de chlorure d`hydrogène, HCl, est de 1,008 gramme par mole d`hydrogène et 35,453 grammes par mole de chlore.La masse molaire de chaque élément du glucose, C6hein12ô6, est 12,0107 fois 6, soit 72,0642 grammes par mole de carbone ; 1,008 fois 12, soit 12,096 grammes par mole d`hydrogène; et 15,9994 fois 6, soit 95,9964 grammes par mole d`oxygène.3. Ajouter les masses molaires de chaque élément du composé. Cela donne la masse molaire du composé. Voici comment procéder :
La masse molaire du chlorure d`hydrogène, est de 1,008 + 35,453 ou 36,461 grammes par mol.La masse molaire du glucose est de 72,0642 + 12,096 + 95,9964, soit 180,1566 grammes par mole.Des astuces
- Alors que dans la plupart des cas, les masses atomiques relatives ont une précision de 4 décimales, en laboratoire une précision de 2 décimales ou moins est vraie pour des masses exceptionnellement grandes. Ainsi, en laboratoire, la masse molaire du chlorure d`hydrogène est de 36,46 grammes par mole et celle du glucose est de 180,16 grammes par mole.
Mises en garde
- Ne pas confondre masse molaire et masse moléculaire. Ce dernier est la masse d`une molécule individuelle d`un élément ou d`un composé. La masse molaire peut être comprise comme la masse moyenne de toutes les molécules dans un échantillon d`une substance donnée, tout comme la masse atomique relative est la moyenne des masses atomiques de tous les isotopes.
Nécessités
- Binas et tableau périodique des éléments
- Calculatrice
Articles sur le sujet "Calcul de la masse molaire"