Parce que les atomes sont extraordinairement petits, les scientifiques travaillent généralement avec des atomes en plus grandes quantités appelées moulin. Une mole est la quantité d`une substance avec autant d`atomes qu`il y en aurait dans 12 grammes de l`isotope carbone-12. Ce nombre est d`environ 600 billions (6 fois 10 à la puissance 23) d`atomes et est connu sous le nom de constante d`Avogadro, d`après le scientifique qui l`a défini. 


Un livre de référence donnera des rapports basés sur toutes les quantités connues d`isotopes d`un élément, tandis que le spectromètre de masse donnera les rapports pour l`échantillon testé. 
Dans l`exemple ci-dessus : 12 x 0,99 = 11,88 pour le carbone-12 et 13 x 0,01 = 0,13 pour le carbone-13. La masse atomique relative est de 11,88 + 0,13 = 12,01. (En raison des rapports d`isotopes, les masses atomiques relatives sur les tableaux périodiques sont rarement des nombres entiers.)
Calculer la masse atomique
Teneur
La masse atomique est la masse d`un isotope spécifique d`un atome donné, mais elle est également utilisée à mauvais escient pour décrire le poids moyen d`un échantillon de différents isotopes du même élément, qui est en fait appelé masse atomique relative ou poids atomique. Quelle que soit la valeur que vous recherchez, nous vous montrerons les étapes pour calculer la masse atomique et la masse atomique relative.
Pas
Méthode 1 sur 2: Calculer la masse atomique

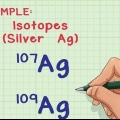
1. Trouver le numéro atomique de l`élément ou de l`isotope. Le numéro atomique est le nombre de protons dans un élément, et il ne change jamais. Par exemple : tous les atomes d`hydrogène, seulement et seul atomes d`hydrogène, ont un proton. Le carbone a le numéro atomique 6 parce que son noyau a six protons tandis que l`oxygène a le numéro atomique 8 parce que son noyau a huit protons.

2. Déterminer le nombre de neutrons dans le noyau. Le nombre de neutrons peut varier au sein d`un atome - bien qu`il s`agisse du même élément, il existe différents isotopes de cet élément. Deux isotopes du même élément auront le même nombre de protons, mais un nombre différent de neutrons.

3. Ignorer le nombre d`électrons en orbite autour du noyau. La masse des électrons d`un atome est négligeable par rapport aux protons et aux neutrons du noyau.

4. Additionner le nombre de protons et de neutrons. C`est la masse atomique de cet atome.
Méthode 2 sur 2: Calculer la masse atomique relative (poids atomique)

1. Déterminer le nombre d`isotopes dans l`échantillon. Les isotopes présents dans l`échantillon peuvent être déterminés à l`aide d`un spectromètre de masse.

2. Déterminer l`abondance relative de chaque isotope dans l`échantillon. Ces informations peuvent être obtenues par spectrométrie de masse ou à partir d`un ouvrage de référence.

3. Multiplier la masse atomique de chaque isotope par son rapport dans l`échantillon. Dans un échantillon contenant du carbone 12 et du carbone 13, si 99 % de l`échantillon est du carbone 12, multipliez 12 par 0,99 et 13 par 0,01.

4. Additionner les résultats. Le total est la masse atomique relative, ou poids atomique, de l`échantillon.
Des astuces
- Certains isotopes sont moins stables que d`autres et se décomposent en éléments avec moins de protons et de neutrons dans leur noyau tout en repoussant des parties d`eux-mêmes. Ces isotopes sont appelés radioactifs.
Nécessités
- Spectromètre de masse
- Ouvrage de référence chimique
- Calculatrice
Articles sur le sujet "Calculer la masse atomique"
Оцените, пожалуйста статью
Populaire