Si c`est un nombre décimal, vous regardez probablement la masse atomique. 
Il peut y avoir un espace vide après les éléments 56 (baryum) et 88 (radium). Il n`y a pas réellement d`espace; les éléments avec les numéros atomiques qui leur appartiennent sont sur deux rangées en dessous du reste du système. La seule raison pour laquelle ils sont séparés comme ça est de rendre le tableau périodique moins large. 
Pour le dire autrement, tout atome avec huit protons est un atome d`oxygène. Deux atomes d`oxygène peuvent avoir un nombre différent de neutrons ou (si l`un est un ion) un nombre différent d`électrons, mais ils auront tous les deux toujours huit protons. 

En pratique, la masse atomique est généralement déjà donnée pour les problèmes de chimie qui traitent d`un seul atome. Comprendre ce concept pour ne pas être surpris s`il diffère du poids atomique. 
Cela fonctionne parce que les neutrons et les protons sont tous deux proches de 1 AMU et les électrons sont proches de 0 AMU. Pour le poids atomique, des mesures précises sont utilisées pour obtenir le nombre décimal, mais nous ne nous intéressons qu`aux entiers qui nous indiquent le nombre de protons et de neutrons. N`oubliez pas que si vous utilisez le poids atomique, vous obtenez une moyenne pour un échantillon typique. Un échantillon de brome a un nombre de masse d`environ 80, mais il s`avère qu`un seul atome de brome a presque toujours un nombre de masse de 79 ou 81. 
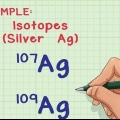
Un seul atome d`hélium (He) a un nombre de masse de 4 et un numéro atomique de 2. Il doit donc être 4 - 2 = 2 neutrons avoir. Un échantillon d`argent (Ag) a un nombre de masse d`environ 108 (selon le tableau périodique) et un numéro atomique de 47. En moyenne, chaque atome d`argent dans l`échantillon a 108 - 47 = 61 neutrons. 
Les isotopes n`ont pas un numéro atomique différent. Chaque isotope d`un élément a le même nombre de protons.
Déterminer le numéro atomique d'un élément
Teneur
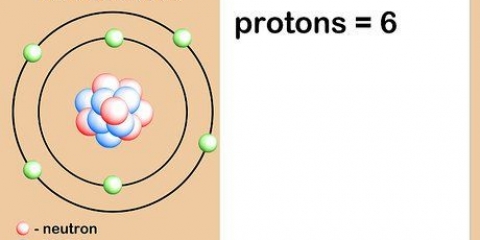
Le numéro atomique d`un élément est le nombre de protons dans le noyau d`un seul atome de cet élément. Le numéro atomique d`un élément ou d`un isotope ne change pas, vous pouvez donc utiliser le numéro atomique pour calculer d`autres caractéristiques d`un élément ou d`un isotope, telles que le nombre de neutrons.
Pas
Partie 1 sur 2: Trouver le numéro atomique

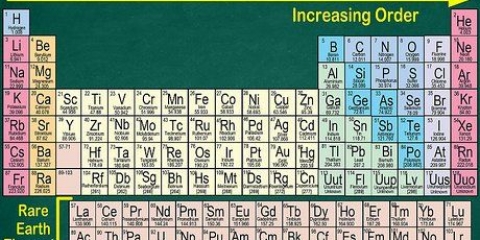
1. Trouver une copie du tableau périodique. Vous pouvez en trouver un ici si vous n`en avez pas sous la main. Chaque élément a un numéro atomique différent, il n`y a donc pas de méthodes rapides et faciles à appliquer. Vous devrez trouver soit une copie du tableau périodique, soit un faut apprendre par coeur.
- La plupart des livres de chimie ont un tableau périodique imprimé sur la couverture intérieure.

2. Trouvez l`élément que vous étudiez. La plupart des tableaux périodiques contiennent les noms complets des divers éléments, ainsi que leurs symboles chimiques (comme Hg pour le mercure). Si vous rencontrez des difficultés pour trouver l`élément, vous devez rechercher en ligne « symbole chimique » suivi du nom de l`élément.

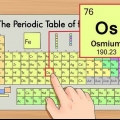
3. Trouver le numéro atomique. Le numéro atomique se trouve généralement dans le coin supérieur gauche ou droit de la boîte dans laquelle se trouve l`élément, mais il peut aussi être ailleurs dans la boîte. Le numéro atomique est toujours un nombre entier.

4. Vérifier par rapport aux éléments voisins. Le tableau périodique est organisé par numéro atomique. Si le numéro atomique de votre élément est « 33 », alors l`élément de gauche doit être « 32 » et l`élément de droite doit être « 34 ». Si cet ordre est correct vous avez définitivement trouvé le numéro atomique.

5. Comprendre ce qu`est le numéro atomique. Il existe une définition simple du numéro atomique d`un élément : le nombre de protons dans un atome de cet élément. C`est la définition de base d`un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine combien d`électrons un atome peut avoir. Étant donné que les électrons sont responsables de presque toutes les réactions chimiques, le numéro atomique détermine indirectement presque toutes les propriétés physiques et chimiques d`un élément.
Partie 2 sur 2: Recherche d`informations connexes

1. Trouver le poids atomique. Le poids atomique est généralement imprimé sous le nom de l`élément en question dans le tableau périodique et est généralement calculé à deux ou trois décimales. Il s`agit de la masse moyenne d`un atome de l`élément, ajustée pour correspondre à ce que vous rencontrez probablement dans la nature. Ce nombre est en "unités de masse atomique" (AMU (de l`anglais "atomic mass unit")).
- Certains scientifiques utilisent le terme « masse atomique relative » au lieu de « poids atomique ».

2. Comprendre ce qu`est la masse atomique. La masse atomique est un concept très similaire à celui du poids atomique. La seule différence est que vous parlez d`un atome spécifique au lieu de la moyenne d`un échantillon. Un gramme de fer contient beaucoup d`atomes avec des masses légèrement différentes les unes des autres, vous recherchez donc le "poids relatif" pour trouver la moyenne. Si vous n`êtes intéressé que par un atome de fer spécifique, la moyenne n`a pas d`importance pour vous - vous n`êtes intéressé que par la masse exacte de cet atome particulier.

3. Arrondir au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d`un élément. Vous pouvez trouver ce nombre facilement : il suffit de prendre le poids atomique donné dans le tableau périodique et d`arrondir au nombre entier le plus proche.

4. Calculer le nombre de neutrons. Vous savez maintenant que le numéro atomique = nombre de protons, et que le nombre de masse = nombre de protons + nombre de neutrons. Pour savoir combien il y a de neutrons dans un élément, il faut soustraire le numéro atomique du nombre de masse. Voici quelques exemples:

5. Comprendre ce que sont les isotopes. Un isotope est une forme spécifique d`un élément avec un certain nombre de neutrons. Lorsqu`une question de chimie parle de "bore-10" ou "B", ils parlent de l`élément bore avec un nombre de masse de 10. Utilisez ce nombre de masse au lieu de la valeur du bore « typique ».
Des astuces
- Certains éléments plus lourds ont des poids atomiques entre parenthèses ou parenthèses. Cela signifie que le poids atomique est la masse exacte de l`isotope le plus stable, plutôt que la moyenne de plusieurs isotopes. (Cela n`a aucun effet sur le numéro atomique de l`élément.)
Articles sur le sujet "Déterminer le numéro atomique d'un élément"
Оцените, пожалуйста статью
Similaire
Populaire