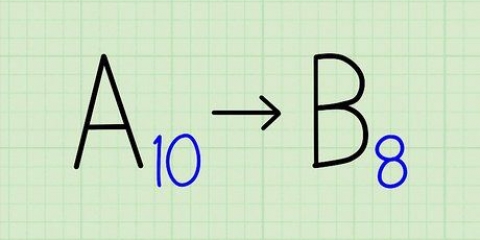N = M – n N = nombre Neutrons M = atome mcul n = atome mnuméro 




N = M – n N = nombre Neutrons M = atome mcul n = atome mnuméro
Déterminer le nombre de neutrons dans un atome
Teneur
Déterminer le nombre de neutrons dans un atome est très simple et vous n`avez même pas besoin de faire une expérience pour cela. Pour calculer le nombre de neutrons dans un atome ou un isotope, il vous suffit de suivre ces instructions.
Pas
Méthode 1 sur 2: Trouver le nombre de neutrons dans un atome

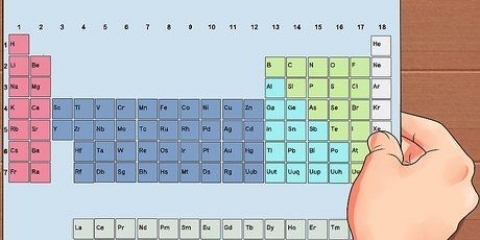
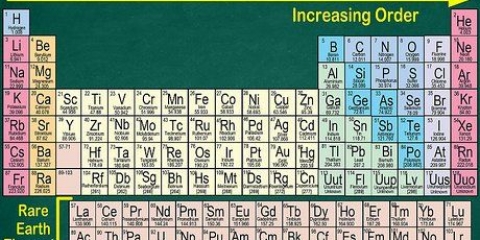
1. Rechercher l`élément sur le tableau périodique. Dans cet exemple, nous regardons Osmium (Os), dans la ligne 6.

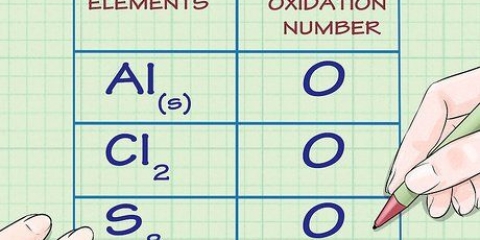
2. Trouver le numéro atomique de l`élément. Il s`agit généralement du nombre au-dessus du symbole de l`élément. (Dans le tableau que nous utilisons c`est le seul nombre.) Le numéro atomique est le nombre de protons dans un atome de cet élément. Os a le numéro 76, ce qui signifie qu`un atome d`osmium a 76 protons.

3. Trouver la masse atomique de l`élément. Il s`agit généralement du nombre sous le symbole de l`élément. (Ceci n`est pas mentionné dans le tableau que nous utilisons).L`osmium a une masse atomique de 190,23.

4. Arrondissez la masse atomique au nombre entier le plus proche pour trouver la masse atomique. Dans notre exemple, 190,23 est ensuite arrondi à 190, ce qui donne une masse atomique de 190 pour l`Osmium.

5. Soustraire le numéro atomique de la masse atomique. Étant donné que la majeure partie du poids d`un atome est absorbée par les protons et les neutrons, en soustrayant le nombre de protons (par ex. le numéro atomique) de la masse atomique donne le nombre de neutrons dans l`atome Les nombres après la virgule représentent la très petite masse des électrons dans l`atome. Dans notre exemple, c`est : 190 (masse atomique) – 76 (nombre de protons) = 114 (nombre de neutrons).

6. Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, utilisez la formule suivante :
Méthode 2 sur 2: Trouver le nombre de neutrons dans un isotope

1. Rechercher l`élément sur le tableau périodique. À titre d`exemple, nous examinons l`isotope du carbone-14. Puisque le carbone-14 est un isotope du carbone (C), essayez de trouver du carbone dans le tableau périodique (dans la deuxième rangée).

2. Trouver le numéro atomique de l`élément. Il s`agit généralement du nombre au-dessus du symbole de l`élément. (Dans le tableau que nous utilisons c`est le seul nombre.) Le numéro atomique est le nombre de protons dans un atome de cet élément. C est le numéro 6, ce qui signifie qu`un atome de carbone a 6 protons.

3. Trouver la masse atomique. Avec les isotopes, c`est très facile, car leur nom est tiré de leur masse atomique. Le carbone 14, par exemple, a une masse atomique de 14. Maintenant que vous connaissez la masse atomique, tout le processus revient à trouver le nombre de neutrons dans un atome ordinaire.

4. Soustraire le numéro atomique de la masse atomique. Étant donné que la majeure partie du poids d`un atome est occupée par les protons et les neutrons, en soustrayant le nombre de protons (i.e. le numéro atomique) de la masse atomique donne le nombre de neutrons dans l`atome. Dans notre exemple, c`est : 14 (masse atomique) – 6 (nombre de protons) = 8 (nombre de neutrons).

5. Rappelez-vous la formule. Pour trouver le nombre de neutrons dans le futur, il suffit d`utiliser la formule suivante :
Des astuces
- L`osmium, un métal solide à température ambiante, tire son nom du mot grec pour odorat, "osme."
- Si vous n`êtes jamais sûr de la signification d`un nombre particulier dans le tableau périodique, rappelez-vous que le tableau est généralement construit autour du numéro atomique (nombre de protons), qui commence au 1 de l`hydrogène et va jusqu`à 118 (Ununoctium). C`est parce que le nombre de protons dans un atome détermine l`atome, ce qui en fait la propriété préférée d`un élément pour une division claire. (par exemple. un atome avec 2 protons est toujours de l`hélium, tout comme un atome avec 79 protons est toujours de l`or.)
Articles sur le sujet "Déterminer le nombre de neutrons dans un atome"
Оцените, пожалуйста статью
Similaire
Populaire