K Shell (interne) : 2 électrons maximum. L Shell : 8 électrons maximum. M Shell : 18 électrons maximum. N Shell : 32 électrons maximum. O Shell : 50 électrons maximum. P Shell (extérieur) : 72 électrons maximum. 
Si la coque de valence est pleine, alors l`élément est stable. Si la coquille de valence n`est pas pleine, l`élément est réactif, ce qui signifie qu`il peut former une liaison chimique avec l`atome d`un autre élément. Chaque atome partage ses électrons de valence pour tenter de remplir la couche de valence. 

L`hydrogène (H) et l`hélium (He) ont tous deux 1 coquille, tandis que le francium (Fr) en a 7. Les lanthanides et actinides sont regroupés et listés sous le tableau principal. Tous les lanthanides appartiennent à la période 6, groupe 3 et tous les actinides appartiennent à la période 7, groupe 3. 
Groupe 1 : 1 électron de valence Groupe 2 : 2 électrons de valence Groupe 13 : 3 électrons de valence Groupe 14 : 4 électrons de valence Groupe 15 : 5 électrons de valence Groupe 16 : 6 électrons de valence Groupe 17 : 7 électrons de valence Groupe 18 : 8 électrons de valence – sauf l`hélium, qui en a 2 

Groupe 3 : 3 électrons de valence Groupe 4 : 2 à 4 électrons de valence Groupe 5 : 2 à 5 électrons de valence Groupe 6 : 2 à 6 électrons de valence Groupe 7 : 2 à 7 électrons de valence Groupe 8 : 2 ou 3 électrons de valence Groupe 9 : 2 ou 3 électrons de valence Groupe 10 : 2 ou 3 électrons de valence Groupe 11 : 1 ou 2 électrons de valence Groupe 12 : 2 électrons de valence
Détermination du nombre d'électrons de valence
Teneur
Les électrons de valence sont situés dans la couche la plus externe d`un élément. Le nombre d`électrons de valence dans un atome détermine le type de liaison chimique que cet élément peut former. La meilleure façon de connaître le nombre d`électrons de valence est d`utiliser le tableau périodique des éléments.
Pas
Méthode 1 sur 3 : Première partie : Comprendre les coquilles d`électrons

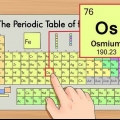
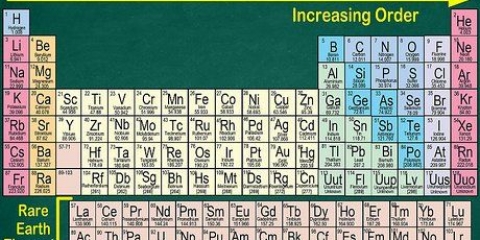
1. Le tableau périodique des éléments. Il s`agit d`un tableau de codes de couleurs, dans lequel chaque cellule affiche un élément avec son numéro atomique et 1 à 3 lettres comme symbole.

2. Trouver le numéro atomique de l`élément. Le numéro atomique est au-dessus ou à côté du symbole de l`élément. Par exemple : le bore (B) a le numéro atomique 5, ce qui signifie qu`il a 5 protons et 5 électrons.

3. Dessinez une représentation simple d`un atome et placez les électrons en orbite autour du noyau. Ces orbites sont également appelées coquilles ou niveaux d`énergie. Le nombre maximum d`électrons qui peuvent être dans la même coquille est fixe, et les coquilles sont remplies de l`orbite la plus intérieure à la plus extérieure.

4. Trouver le nombre d`électrons dans la couche externe. Ce sont les électrons de valence.
Méthode 2 sur 3 : Deuxième partie : Recherche d`électrons de valence dans les métaux à l`exception des métaux de transition

1. Numérotez chaque colonne du tableau périodique, de 1 à 18. L`hydrogène (H) est en haut de la colonne 1 et l`hélium (He) est en haut de la colonne 18. Ce sont les différents groupes d`éléments.

2. Numérotez chaque ligne, de 1 à 7. Ce sont les périodes des éléments, et elles correspondent au nombre de coquilles ou niveaux d`énergie d`un atome.

3. Localisez un élément qui n`est pas un métal de transition. Les métaux de transition sont dans les groupes 3 à 12. Les numéros de groupe des autres métaux indiquent le nombre d`électrons de valence.
Méthode 3 sur 3 : Troisième partie : Recherche d`électrons de valence dans les métaux de transition

1. Trouvez un élément des groupes 3 à 12, les métaux de transition.

2. Déterminer le nombre d`électrons de valence en fonction du nombre de groupe. Ces numéros de groupe correspondent à un nombre possible d`électrons de valence.
Des astuces
- Les métaux de transition peuvent avoir des coquilles de valence qui ne sont pas complètement pleines. Déterminer le nombre exact d`électrons de valence dans les métaux de transition nécessite certains principes de la théorie quantique qui dépassent le cadre de cet article.
Nécessités
- Tableau périodique des éléments
- Crayon
- Papier
Articles sur le sujet "Détermination du nombre d'électrons de valence"
Оцените, пожалуйста статью
Similaire
Populaire