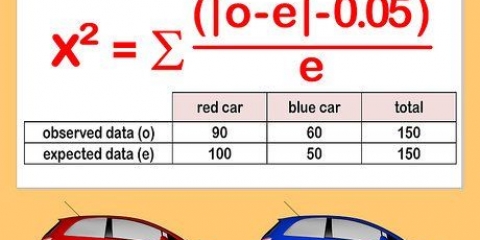
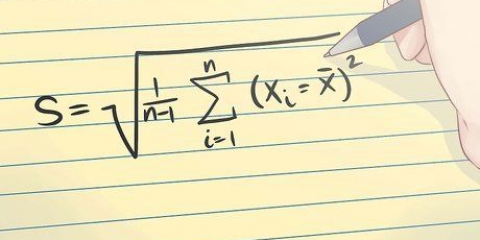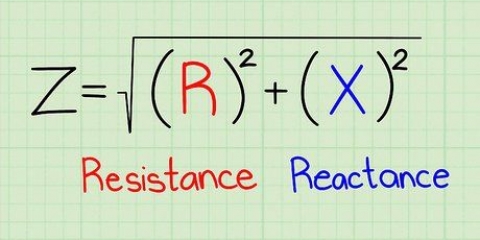L`absorbance mesurée entre différentes lectures peut varier en raison de la concentration de la solution et de la forme du récipient utilisé pour mesurer l`intensité. L`absorbance molaire compense ces variations. 
Préparez une solution avec un concentration, c, pour analyse. L`unité de concentration est donnée en moles ou moles/litre. À je pour trouver, mesurer la longueur de la cuvette. L`unité de longueur du chemin est le centimètre. Utiliser un spectrophotomètre pour obtenir une lecture d`absorbance une à une longueur d`onde donnée. L`unité de longueur d`onde est le mètre, mais la plupart des longueurs d`onde sont si petites qu`elles sont en fait mesurées en nanomètres (nm). L`absorbance n`a pas d`unité. 
Par exemple : avec une cuvette de 1 cm, vous mesurez l`absorbance d`une solution avec une concentration de 0,05 mol/L. L`absorbance à une longueur d`onde de 280 nm est de 1,5. Quelle est l`absorbance molaire de cette solution ?? ??280 = A/lc = 1.5/(1 x 0.05) = 30 L mol.cm 

Tracez une ligne entre chacun des points. Si les mesures sont correctes, les points doivent former une ligne droite indiquant que l`absorbance et la concentration correspondent à la loi de Beer. 
L`équation de la pente ou de la pente d`une ligne est (Y2 - Oui1)/(X2 - X1). Le point le plus haut sur la ligne obtient 2 en indice et le point le plus bas obtient 1 en indice. Par exemple, l`absorbance à une concentration molaire de 0,2 est de 0,27 et à une concentration molaire de 0,3 l`absorbance est de 0,41. Les valeurs de l`absorbance sont des valeurs Y tandis que les concentrations sont des valeurs X. En utilisant l`équation d`une droite, on calcule : (Y2 - Oui1)/(X2 - X1) = (0.41-0.27)/(0.3-0.2) = 0.14/0.1 = 1.4 est la pente de la droite. 
Poursuivant notre exemple : si 1,4 est la pente de la ligne et la longueur du trajet est de 0,5 cm, alors l`absorbance molaire est de 1,4/0,5 = 2,8 L mol cm.
Calcul de l'absorbance molaire
Teneur
L`absorbance molaire, également connue sous le nom de coefficient d`extinction molaire, est une mesure de l`absorption d`une longueur d`onde particulière de la lumière par un produit chimique. Il vous permet de faire des comparaisons entre les composés sans prendre en compte les différences de concentration ou de longueur de solution lors des mesures. Il est souvent utilisé en chimie et ne doit pas être confondu avec le coefficient d`extinction car il est généralement utilisé en physique. Les unités standard pour l`absorbance molaire sont les litres par mole centimètre (L mole cm).
Pas
Méthode 1 sur 2: Calcul de l`absorbance molaire avec une équation

1. Comprendre la loi d`extinction de Beer-Lambert, A = lc. L`équation standard pour l`absorbance est A = lc, vrai une représente la quantité de lumière absorbée par l`échantillon pour une longueur d`onde donnée, ?? est l`absorbance molaire, je est la distance parcourue par la lumière à travers la solution, et c est la concentration des absorbants par unité de volume.
- L`absorption peut également être calculée en utilisant le rapport entre l`intensité d`un échantillon de référence et l`échantillon inconnu. Ceci est donné par l`équation A = journaldix(JEô/JE).
- L`intensité peut être obtenue à l`aide d`un spectrophotomètre.
- L`absorbance d`une solution change en fonction de la longueur d`onde dans la solution. Certaines longueurs d`onde seront absorbées plus que d`autres selon la composition de la solution. N`oubliez pas de mentionner la longueur d`onde que vous utilisez pour le calcul.

2. Réorganiser l`équation de Beer-Lambert pour résoudre l`absorbance molaire. En utilisant l`algèbre, nous pouvons diviser l`absorbance par la longueur et la concentration, pour isoler l`absorbance molaire d`un côté de l`équation : = A / lc. Nous pouvons maintenant utiliser cette équation de base pour calculer l`absorbance molaire pour une longueur d`onde donnée.

3. Obtenez les valeurs des variables de l`équation à l`aide de la spectrophotométrie. Un spectrophotomètre est un appareil qui envoie une longueur d`onde de lumière spécifique à travers une substance et détecte la quantité de lumière qui en sort à nouveau. Une partie de la lumière sera absorbée par la solution et la lumière restante qui est transmise peut être utilisée pour calculer l`absorbance de cette solution.

4. Appliquer les valeurs des variables à l`équation d`absorbance molaire à résoudre. En utilisant les valeurs que vous avez obtenues pour une, c et je, remplir l`équation = A / lc dans. Multiplier je de c et partager une puis à travers le produit, pour obtenir l`absorbance molaire.
Méthode 2 sur 2: Calcul de l`absorbance molaire en utilisant la meilleure solution

1. Mesurer l`intensité de la lumière transmise à travers différentes concentrations d`une solution. Faire trois ou quatre concentration d`une solution. Utiliser un spectrophotomètre pour mesurer l`absorbance d`une concentration de solution à une longueur d`onde donnée. Commencez avec la concentration la plus faible de la solution et progressez jusqu`à la plus élevée. L`ordre n`a pas d`importance, mais il est important de savoir quelle absorbance appartient à quel calcul.

2. Tracer la concentration en fonction de l`absorbance sur un graphique. Utilisez les valeurs obtenues avec le spectrophotomètre pour tracer un graphique. Pour chaque valeur individuelle, placez la concentration sur l`axe des x et l`absorbance sur l`axe des y.

3. Particulierpente de la ligne de meilleur ajustement, en utilisant les points sur le graphique. Pour calculer la pente de la droite, divisez l`absorbance par la concentration. En utilisant deux de vos points de graphique, soustrayez les valeurs X et Y, puis calculez Y/X.

4. Divisez la pente de la ligne par la longueur du chemin (la profondeur/largeur de la cuvette) pour calculer l`absorbance molaire. La dernière étape pour calculer l`absorbance molaire avec des points de données est de diviser par la longueur du chemin. C`est la profondeur de la cuvette utilisée dans le spectrophotomètre.
Articles sur le sujet "Calcul de l'absorbance molaire"
Оцените, пожалуйста статью
Similaire
Populaire