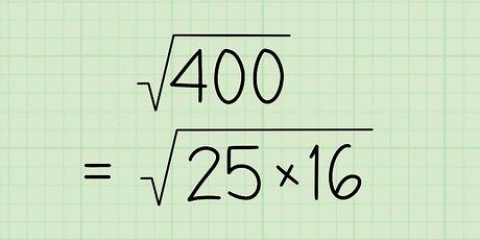La convention est de mesurer la masse en grammes ou, si la masse est suffisante, en kilogrammes. En raison de la faible masse des gaz, ils sont également mesurés sous une autre forme de masse, à savoir la masse moléculaire ou la masse molaire. La masse molaire est définie comme la somme de la masse atomique de chaque atome dans la composition qui compose le gaz, en comparant chaque atome à la valeur 12 pour le carbone. Puisque les atomes et les molécules sont trop petits pour travailler avec, une quantité de gaz est définie comme le nombre de Mol. Le nombre de moles présentes dans un gaz donné peut être trouvé en divisant la masse par la masse molaire, et cela est représenté par la lettre n. Nous pouvons remplacer la constante arbitraire k dans l`équation du gaz par le produit de n, le nombre de Moles et une nouvelle constante R. L`équation peut maintenant être écrite sous la forme nR = PV/T ou PV = nRT. La valeur de R dépend des unités utilisées pour mesurer la pression, le volume et la température des gaz. Basé sur le volume en litres, la température en degrés Kelvin et la pression dans l`atmosphère, sa valeur est de 0,0821 l atm/K mol. Cela peut être noté comme 0,0821 L atm. K mol pour éviter le signe de division dans les unités. 
La loi de Dalton peut être écrite sous la forme d`une équation comme Ple total = P1 + p2 + p3 …avec autant d`ajouts à la fin du signe égal qu`il y a de gaz dans le mélange. La loi de Dalton peut être étendue lorsque l`on travaille avec des gaz dont les pressions partielles individuelles sont inconnues, mais dont le volume et la température sont connus. La pression partielle d`un gaz est la même que la pression de ce gaz quand c`est le seul gaz dans le récipient. Pour toute pression partielle, nous pouvons réécrire l`équation des gaz parfaits de sorte qu`au lieu d`utiliser la formule PV = nRT, nous n`ayons que P à gauche du signe égal. Pour ce faire, on divise les deux côtés par V : PV / V = nRT / V. Les deux V à gauche s`annulent, nous laissant avec P = nRT/V. Nous pouvons alors placer n`importe quelle instance de P du côté droit de l`équation de pression partielle avec un indice : Ple total =(nRT/V) 1 + (nRT/V) 2 + (nRT/V) 3 .. 


Chaque atome du premier gaz, l`azote (N2), a un poids atomique de 14. Puisque l`azote est diatomique (il forme des molécules diatomiques), nous devons multiplier 14 par 2 pour calculer que la concentration d`azote dans l`échantillon a une masse molaire de 28. Ensuite, nous divisons la masse, 10 g, par 28, et obtenons le nombre de moles, que nous arrondissons à 0,4 mole d`azote. Chaque atome du second gaz, l`oxygène (O2), a un poids atomique de 16. L`oxygène est également diatomique, nous multiplions donc 16 par 2 et trouvons que l`oxygène dans notre exemple a une masse molaire de 32. Divisez 10 g par 32 et nous obtenons environ 0,3 mole d`oxygène comme réponse. Le troisième gaz, le dioxyde de carbone (CO2), a 3 atomes : un atome de carbone avec un poids atomique de 12 et deux atomes d`oxygène, chacun avec un poids atomique de 16. On additionne les trois poids : 12 + 16 + 16 = 44 est la masse molaire. Divisez 10 g par 44 et nous obtenons environ 0,2 mole de dioxyde de carbone comme réponse. 
Par souci de simplicité, nous avons omis les unités des valeurs. Ces unités seront décalées les unes par rapport aux autres lors du calcul, ne laissant que l`unité d`affichage de la pression. 

Pour la pression partielle d`azote, on multiplie 0,4 mole par notre constante 0,0821 et la température de 310 degrés K, puis on divise par 2 litres : 0,4 * 0,0821 * 310 / 2 = 5,09 atm. (environ). Pour la pression partielle d`oxygène, nous multiplions 0,3 mole par la constante 0,0821 et notre température de 310 degrés K, en divisant à nouveau par 2 litres : 0,3 * 0,0821 * 310 / 2 = 3,82 atm. (environ). Pour la pression partielle de dioxyde de carbone, nous multiplions 0,2 mole par la constante de 0,0821 et notre température de 310 degrés K, que nous divisons par 2 litres : 0,2 * 0,0821 * 310 / 2 = 2,54 atm. (environ). Additionnez maintenant chaque pression pour la pression totale : Ple total = 5,09 + 3,82 + 2,54, ou 11,45 atm. (environ). 

0,4 + 0,3 + 0,2 = 0,9 mol du mélange gazeux. Cela simplifie encore l`équation en : Ple total = 0.9*0.0821*310/2. 

Il y a 0,4 mole d`azote, donc 0,4 / 0,9 = 0,44 (44 %) de l`échantillon (environ). Il y a 0,3 mole d`oxygène, donc 0,3 / 0,9 = 0,33 (33 %) de l`échantillon (environ). Il y a 0,2 mole de dioxyde de carbone, donc 0,2 / 0,9 = 0,22 (22 %) de l`échantillon (environ). Bien que les pourcentages estimés ci-dessus s`élèvent à 0,99, en réalité les décimales continuent de se répéter, donc la somme est en fait une série répétée de neuf après la virgule décimale. Par définition, c`est la même chose que 1, ou 100 pour cent. 
Multiplier 0,44 * 11,45 = 5,04 atm. (environ). Multiplier 0,33 * 11,45 = 3,78 atm. (environ). Multiplier 0,22 * 11,45 = 2,52 atm. (environ).
Calculer la pression partielle
Teneur
En chimie, la « pression partielle » fait référence à la pression que n`importe quel gaz dans un mélange gazeux exerce sur son environnement, comme une fiole Erlenmeyer, une bouteille d`oxygène de plongeur ou la limite de l`atmosphère. Vous pouvez calculer la pression de chaque gaz dans un mélange séparément si vous savez quelle quantité de ce gaz est présente, quel volume il occupe et quelle est sa température. Vous pouvez ensuite additionner ces pressions partielles pour la pression totale du mélange gazeux, ou vous calculez d`abord la pression totale, puis déterminez la pression partielle de chaque gaz.
Pas
Partie1 sur 3: Comprendre les propriétés des gaz

1. Traitez n`importe quel gaz comme un gaz « idéal ». Un gaz parfait en chimie est un gaz qui interagit avec d`autres gaz sans être attiré par leurs molécules. Les molécules individuelles peuvent se heurter et rebondir comme des boules de billard, sans être déformées de quelque façon que ce soit.
- La pression des gaz parfaits augmente lorsqu`ils sont comprimés dans des espaces plus petits et diminue lorsqu`ils disposent de plus d`espace. Cette relation s`appelle la loi de Boyle, du nom de Robert Boyle. Son équation est k = P x V, ou plus généralement, k = PV, où k est la relation constante, P est la pression et V est le volume.
- La pression peut être donnée dans l`une des unités de mesure possibles. Une possibilité est le Pascal (Pa), défini comme la force d`un Newton sur un mètre carré. Un autre est l`atmosphère (atm.), définie comme la pression de l`atmosphère au niveau de la mer. Une pression de 1 atm. est égal à 101 325 Pa.
- La température d`un gaz parfait augmente ou diminue avec le volume du gaz. Cette relation s`appelle la loi de Charles, du nom de Jacques Charles. Mathématiquement, vous écrivez cela comme k = V / T, où k est la relation constante entre le volume et la température, V est le volume et T est la température.
- Dans cette équation, la température des gaz est exprimée en degrés Kelvin, qui peuvent être convertis en ajoutant 273 au nombre de degrés Celsius.
- Ces deux relations peuvent être combinées en une seule équation : k = PV / T, qui peut aussi s`écrire PV = kT.

2. Définir les quantités dans lesquelles les gaz sont mesurés. Les gaz ont à la fois une masse et un volume. Le volume est généralement mesuré en litres (l), mais il existe deux types de masse.

3. Comprendre la loi de la pression partielle de Dalton. La loi de Dalton, comme son nom l`indique, a été développée par le chimiste et physicien John Dalton, qui a été le premier à développer l`idée que les éléments chimiques sont constitués d`atomes, et déclare que la pression totale d`un mélange gazeux est égale à la somme de la pression de chacun des gaz du mélange.
Partie 2 sur 3: Calcul de la pression partielle puis totale

1. Définir l`équation de pression partielle pour les gaz avec lesquels vous travaillez. Pour les besoins de ce calcul, nous supposons qu`un erlenmeyer de 2 litres contient 3 gaz : l`azote (N2), l`oxygène (O2) et le dioxyde de carbone (CO2). Chaque gaz pèse 10 g et la température de chaque gaz dans l`Erlenmeyer est de 37 degrés Celsius. Nous devons déterminer la pression partielle de chaque gaz et la pression totale que le mélange gazeux exerce sur le ballon.
- Notre équation de la pression partielle devient maintenant Ple total = Pazote + poxygène + pgaz carbonique.
- Puisque nous essayons de déterminer la pression de chaque gaz, nous connaissons son volume et sa température, et nous pouvons calculer combien de moles de chaque gaz sont présentes en fonction de sa masse, nous pouvons réécrire cette équation comme suit : Ple total =(nRT/V) azote + (nRT/V) oxygène + (nRT/V) gaz carbonique

2. Convertir la température en degrés Kelvin. La température est de 37 degrés Celsius, donc nous ajoutons 273 et obtenons 310 degrés K.

3. Déterminer le nombre de moles de chaque gaz présent dans l`échantillon. Le nombre de moles d`un gaz est la masse de ce gaz divisée par sa masse molaire, la somme de la masse atomique de chaque atome dans sa composition.

4. Remplissez les valeurs pour les moles, le volume et la température dans l`équation. Notre équation ressemble maintenant à ceci : Ple total=(0.4 * R * 310 / 2)azote+(0,3*R*310/2)oxygène+(0,2 * R * 310 / 2)gaz carbonique.

5. Entrez la valeur de la constante R. Nous allons rapporter les pressions partielles et totales dans l`atmosphère, nous allons donc utiliser la valeur pour R de 0,0821 L atm/K mol. Branchez cette valeur dans l`équation et nous obtenons la réponse : Ptotal donne=(0.4 * 0.0821 * 310 / 2)azote+(0,3*0,0821*310/2)oxygène+(0,2 * 0,0821 * 310 / 2)gaz carbonique.

6. Calculer la pression partielle pour chaque gaz. Maintenant que nous avons les valeurs, il est temps de faire les calculs mathématiques.
Partie3 sur 3: Calcul de la pression totale et partielle

1. Définir l`équation de pression partielle comme avant. Encore une fois, supposons un erlenmeyer de 2 litres avec 3 gaz : azote (N2), l`oxygène (O2) et le dioxyde de carbone (CO2). Il y a 10 g de chaque gaz, et la température de chaque gaz dans le ballon est de 37 degrés Celsius.
- La température Kelvin est toujours d`environ 310 degrés, et comme auparavant, nous avons environ 0,4 mole d`azote, 0,3 mole d`oxygène et 0,2 mole de dioxyde de carbone.
- De même, nous enregistrerons à nouveau la pression dans l`atmosphère, en utilisant donc 0,0821 L atm/K mol comme valeur de la constante R.
- Ainsi, l`équation de la pression partielle est toujours la même à ce stade : Ple total=(0.4 * 0.0821 * 310 / 2)azote+(0,3*0,0821*310/2)oxygène+(0,2 * 0,0821 * 310 / 2)gaz carbonique.

2. Additionnez les moles de chaque gaz dans l`échantillon pour déterminer le nombre total de moles dans le mélange gazeux. Étant donné que le volume et la température sont les mêmes pour chaque échantillon dans le gaz, sans parler du fait que chaque valeur molaire est multipliée par la même constante, nous pouvons utiliser la propriété distributive des mathématiques pour réécrire l`équation sous la forme Ple total = (0,4 + 0,3 + 0,2) * 0,0821 * 310 / 2.

3. Déterminer la pression totale du mélange gazeux. 0,9 * 0,0821 * 310 / 2 = 11,45 moles (environ).

4. Déterminer la quantité de chaque gaz dans le mélange gazeux total. Pour ce faire, divisez le nombre total de moles par le nombre de moles de chaque gaz.

5. Multipliez la quantité proportionnelle de chaque gaz par la pression totale pour déterminer la pression partielle.
Des astuces
- Vous remarquerez fondamentalement une petite différence dans les valeurs allant de la pression partielle à la détermination de la pression totale, par rapport à la détermination de la pression totale d`abord, puis de la pression partielle. Gardez à l`esprit que les valeurs indiquées sont des approximations, dues à l`arrondi à 1 ou 2 décimales (elles sont donc plus faciles à comprendre. Si vous effectuez vous-même les calculs avec une calculatrice sans arrondir, vous remarquerez soit une différence plus petite entre les deux méthodes, soit aucune différence.
Mises en garde
- La connaissance des pressions partielles des gaz peut être la vie ou la mort pour les plongeurs. Une pression partielle d`oxygène trop basse peut provoquer une perte de conscience ou la mort, tandis qu`une pression partielle d`azote et d`oxygène trop élevée peut également être toxique.
Nécessités
- Calculatrice
- Ouvrage de référence sur les poids atomiques/masses molaire
Articles sur le sujet "Calculer la pression partielle"
Оцените, пожалуйста статью
Populaire