Exemple : Al2ô3. Déjà2 = Aluminium ; ô3 = oxygène. Le nom devient donc « oxyde d`aluminium ». 
Exemple : FeCl2 et FeCl3. Fe = fer ; Cl2 = Chlorure -2;Cl3 = Chlorure -3. Les noms seraient chlorure de fer (II) et chlorure de fer (III). 

Retirer un atome d`oxygène de la liaison. La charge reste la même et la fin du nom de l`obligation passe de "-aat" à "-iet". A titre d`exemple : NON3 à NON2 passe de « nitrate » à « nitrite."
Remplacer l`atome central par un autre du même groupe périodique. A titre d`exemple : Sulfate SO4 peut se transformer en Selenate SeO4.

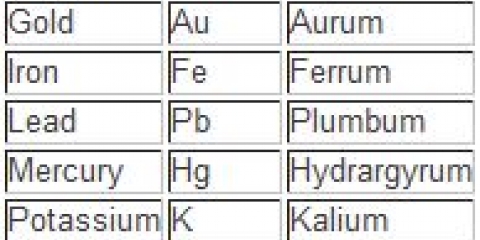
Ion hydroxyde : OH Ion nitrate : NON3 Ion carbonate d`oxygène : HCO3 Ion permanganate : MnO4 Ion carbonate : CO3 Ion chromate : CrO4 Ion bichromate : Cr2ôsept Ion sulfate : SO4 Ion sulfite : SO3 Ion thiosulfate : S2ô3<2- ion phosphate : PO4 Ion ammonium : NH4 Exemple : KMnO4. Vous pouvez utiliser le MnO4 l`ion doit reconnaître comme permanganate. K est le potassium, donc le nom de la liaison est le permanganate de potassium.
Exemple : NaOH. Vous devriez reconnaître l`ion OH comme un hydroxyde. Na est le sodium, donc le nom de la liaison sera l`hydroxyde de sodium.


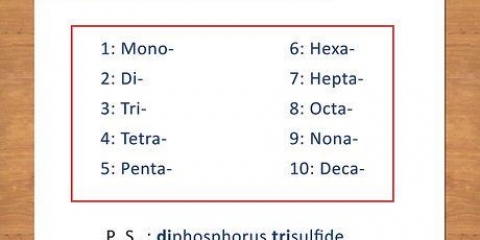
1 atome - "Mono-" 2 atomes – « Di- » 3 atomes - "Tri-" 4 atomes - "Tétra-" 5 atomes - "Penta-" 6 atomes - "Hexa-" 7 atomes - "Hepta-" 8 atomes - "Octa-" Exemple : le CO devient alors monoxyde de carbone et CO2 devient du dioxyde de carbone.
Exemple : N2s3 devient alors trisulfure de diazote.
Dans la plupart des cas, la préposition « mono- » peut être omise, car elle est signifiée lorsqu`elle n`est pas présente. Il est toujours utilisé pour le monoxyde de carbone en raison du fait que le terme est utilisé depuis les débuts de la chimie.
Nommer les liaisons chimiques
Teneur
Nommer les liaisons chimiques standards est essentiel pour réussir en chimie. Suivez ce guide pour quelques règles de base sur la façon dont les liaisons chimiques obtiennent leurs noms et pour apprendre à nommer les liaisons chimiques avec lesquelles vous n`êtes pas familier.
Pas
Méthode 1 sur 3: Nommer les liaisons ioniques

1. Comprendre pourquoi quelque chose est une liaison ionique. Les liaisons ioniques contiennent un métal et un non-métal. Consultez le tableau périodique des éléments pour voir à quelle catégorie appartiennent les éléments du lien.

2. Former le nom. La dénomination d`une liaison ionique de deux éléments est simple. La première partie du nom est le nom du métal. La deuxième partie est le nom du non-métal, avec le suffixe "-ide."

3. Reconnaître les métaux de transition. Les métaux des blocs d et f du tableau périodique sont appelés métaux de transition. Leur charge est indiquée par un chiffre romain, lorsque le nom du lien est inscrit. C`est parce qu`ils peuvent avoir plus d`une charge et former plus d`une liaison.
Méthode 2 sur 3: La dénomination des liaisons polyatomiques

1. Comprendre ce qu`est une liaison polyatomique. Ces liaisons sont constituées de groupes d`atomes liés entre eux, le groupe complet ayant une charge négative ou positive. Vous pouvez faire trois choses avec les liaisons polyatomiques :
- Ajouter un atome d`hydrogène au début de la liaison. Le mot « hydrogène » est ajouté au début du nom de la liaison. Cela réduit la charge négative d`un. À titre d`exemple, le CO « carbonate »3 devient HCO « hydrogénocarbonate »3.




2. Mémoriser les groupes d`ions les plus courants. Ceux-ci forment la base pour faire la plupart des liaisons polyatomiques. Dans l`ordre de la plus grande charge négative, ils sont :
3. Créer des noms de liaison basés sur la liste. Inclure tous les éléments appartenant au groupe ion dans le nom. Si l`élément vient avant le groupe ionique, il suffit d`ajouter le nom de l`élément au début du nom de la liaison.


Méthode 3 sur 3: La dénomination des liaisons covalentes

1. Comprendre ce qu`est une liaison covalente. Les liaisons covalentes sont formées par deux ou plusieurs non-métaux. Le nom de la liaison est basé sur la quantité d`atomes présents. La préposition ajoutée est le terme latin pour la quantité de molécules.

2. Apprendre les prépositions. Mémorisez les prépositions à 8 atomes :
3. Nommer les liaisons. Nommez le nouveau lien en utilisant des prépositions. Vous attachez des prépositions à n`importe quelle partie de la liaison qui a plusieurs atomes.



Des astuces
- Il est également très important de comprendre que cela ne s`applique pas à la biochimie.
- Ces règles sont conçues pour les personnes qui débutent en chimie et en sciences. Il existe différentes règles lorsque vous arrivez à la chimie avancée, par exemple les règles de valence variable.
- Bien sûr, ces règles ont toutes de nombreuses exceptions. Par exemple, même si CaCl a2 un 2 à la fin, cela s`appelle toujours chlorure de calcium et PAS dichlorure de calcium, comme on pourrait s`y attendre.
Articles sur le sujet "Nommer les liaisons chimiques"
Оцените, пожалуйста статью
Populaire