Li2S = sulfure de lithium
Ag2S = sulfure d`argent
MgCl2 = Chlorure de magnesium












Nommer les liaisons ioniques
Teneur
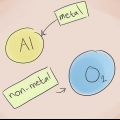
Les liaisons ioniques sont constituées de cations (ions positifs) et d`anions (ions négatifs). Les liaisons ioniques se composent généralement d`un métal et d`un ou plusieurs non-métaux. Pour nommer une liaison ionique, il suffit de trouver le nom du cation et de l`anion présents dans le composé. Vous devez d`abord écrire le nom du métal, suivi du nom du non-métal avec sa nouvelle terminaison correspondante. Si vous voulez savoir comment nommer les liaisons ioniques dans différentes situations, suivez simplement ces étapes.
Pas
Méthode 1 sur 3 : Liaisons ioniques basiques

1. Ecrire la formule de la liaison ionique. Disons la liaison ionique sur laquelle vous travaillez NaCl est.

2. Notez le nom du métal ou du cation. C`est l`ion chargé positivement dans la liaison et il est toujours écrit en premier dans la formule d`une liaison ionique. Après est le sodium. Alors écris Sodium au.

3. Écrivez le nom du non-métal, ou anion, avec le "-idée" Sortir.Cl est le chlore (chlore). Autour du "idée" pour ajouter une fin, vous n`avez besoin que de la dernière syllabe "-iné" être remplacé par "-idée". Le chlore devient chlorure.

4. Combiner les noms. NaCl peut être écrit comme chlorure de sodium.

5. Entraînez-vous à nommer des liaisons ioniques simples. Une fois que vous avez réussi cette formule, essayez de nommer des liaisons ioniques plus simples. Mémoriser même quelques-unes peut vous aider à mieux comprendre comment nommer les liaisons ioniques. En voici d`autres :



Méthode 2 sur 3 : Métaux de transition

1. Ecrire la formule de la liaison ionique. Les métaux de transition se trouvent au milieu du tableau périodique. Ils tirent leur nom parce que leurs nombres d`oxydation, ou leurs charges, changent constamment. Disons que vous travaillez avec ce lien : Fe2ô3.

2. Notez la charge du métal. Vous savez que le métal aura une charge positive, vous pouvez donc utiliser le 3 de ô3 rayer et écrire que Fe a une charge de +3. (Vous pouvez, pour le plaisir, faire l`inverse et écrire que ô a une charge de -2.) Parfois, la charge sera déclarée.

3. Notez le nom du métal. Puisque tu sais que Fe fer et qu`il a une charge de +3, vous pouvez Fer(III) à mentionner. N`oubliez pas d`utiliser uniquement des chiffres romains lors de l`écriture du nom et non lors de l`écriture de la formule.

4. Notez le nom du non-métal. Puisque tu sais que ô signifie oxygène, vous pouvez utiliser le "-idée" ajouter une sortie et il "oxyde" à mentionner.

5. Fusionner le prénom et le deuxième nom. Maintenant tu l`as. Fe2ô3 = Oxyde de fer (III).

6. Utiliser l`ancienne méthode de nommage. Vous utilisez l`ancienne méthode de nommage, qui est également utilisée, le "ferreux" et "ferrique" noms pour les métaux, au lieu des chiffres romains. Si l`ion métallique a un état d`oxydation inférieur (une charge numérique inférieure, où vous "+" ou "-" ignore), vous utilisez "ferreux". S`il a une charge plus élevée, utilisez "ferrique". Fe a l`état inférieur (Fe a l`état supérieur), donc il devient ferreux. Le nom de FeO peut également être écrit comme oxyde ferrique.

sept. Rappelez-vous les exceptions. Il existe deux métaux de transition qui n`ont pas de charge fixe. Ce sont le zinc (Zn) et l`argent (Ag). Cela signifie que vous n`avez pas besoin d`utiliser les chiffres romains ou l`ancienne méthode de dénomination pour décrire ces éléments.
Méthode 3 sur 3: Liaisons avec des ions polyatomiques

1. Ecrire la formule de l`ion polyatomique. Cette liaison sera constituée de plus de deux ions. Disons que vous travaillez sur le lien suivant : FeNH4(ALORS4)2.

2. Trouver la charge du métal. il faudra faire des calculs pour le trouver. Tout d`abord vous savez que le sulfate, ou le SO4 ion, a une charge de -2 et qu`il y en a deux, à cause du 2 sous la parenthèse. Donc, 2 x -2 = -4. Alors vous savez que NH4, si l`ion ammoniac a une charge de +1. Ajoutez -4 et 1 ensemble et vous obtenez -3. Cela signifie que l`ion fer, Fe, doit avoir une charge de +3 pour égaliser et rendre la liaison neutre.

3. Notez le nom du métal. Dans ce cas, vous pouvez soit Fer(III) si ferrique écrire.

4. Notez le nom des ions non métalliques. Dans ce cas, vous utilisez ammonium et sulfate, ou sulfate d`ammonium.

5. Combinez le nom du métal avec les noms des non-métaux. Vous pouvez nommer la liaison FeNH4(ALORS4)2 transmettre soit sulfate de fer (III) d`ammonium ou sulfate d`ammonium ferrique écrire.
Des astuces
- Si vous allez dans le sens inverse et que vous avez des chiffres romains, vous devez faire une « radiographie » de la molécule. Le chiffre romain est la charge du cation.
Articles sur le sujet "Nommer les liaisons ioniques"
Оцените, пожалуйста статью
Populaire