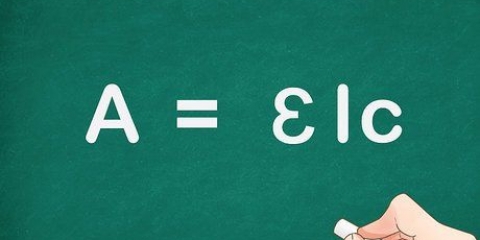Soyez prudent avec les cuvettes car elles peuvent être assez chères, surtout si elles sont en verre ou en quartz. Les cuvettes en quartz sont conçues pour une utilisation en spectrophotométrie UV-visible. Lors de la manipulation de la cuvette, ne touchez pas les côtés que la lumière traversera (généralement, les côtés clairs du tube). Si vous touchez accidentellement ces côtés, essuyez la cuvette avec un « kimwipe » (formulé pour éviter de rayer le verre). 
Si vous utilisez une pipette pour charger vos échantillons, utilisez une nouvelle pointe pour chaque échantillon afin d`éviter la contamination croisée. 



Les spectrophotomètres numériques peuvent être calibrés de la même manière, ils n`auront qu`un affichage numérique. Réglez le blanc à zéro avec les boutons de réglage. Lorsque vous retirez le blanc, le calibrage est toujours correct. Lors de la mesure du reste des échantillons, l`absorbance du blanc est automatiquement soustraite. Assurez-vous d`utiliser un seul blanc par session afin que chaque échantillon soit calibré sur le même blanc. Par exemple, si vous videz le spectrophotomètre, puis analysez seulement quelques échantillons et videz à nouveau le spectrophotomètre, les échantillons restants seraient inexacts. Ensuite il faut recommencer. 
Si l`aiguille ou la lecture n`est pas à zéro, répétez les étapes d`étalonnage avec le blanc. Si vous continuez à avoir des problèmes, obtenez de l`aide ou faites vérifier l`appareil pour les problèmes. 
L`absorbance est également connue sous le nom de densité optique (DO). Plus il y a de lumière qui passe, moins l`échantillon absorbe de lumière. En général, vous noterez les valeurs d`absorbance, qui seront généralement données sous forme de décimales. Par exemple : 0,43. Si vous obtenez un résultat anormal (comme 0,900 alors que le reste est autour de 0,400), diluez l`échantillon et mesurez à nouveau l`absorbance. Répétez la mesure pour chaque échantillon individuel au moins trois fois et faites la moyenne des mesures. Cela permet une lecture plus précise. 


Un spectre d`absorption a généralement des pics à certaines longueurs d`onde qui vous permettent d`identifier des composés spécifiques. 
Vous pouvez également utiliser cette méthode pour identifier les contaminants dans votre échantillon. Si vous vous attendez à un pic clair à une certaine longueur d`onde et que vous obtenez deux pics à des longueurs d`onde différentes, alors vous savez que quelque chose ne va pas dans votre échantillon.
Effectuer une analyse spectrophotométrique
Teneur
La spectrophotométrie est une technique expérimentale utilisée pour mesurer la concentration de solutés dans une solution spécifique, en calculant la quantité de lumière absorbée par ces solutés. Cette technique est puissante car certains composés vont absorber différentes longueurs d`onde de lumière avec différentes intensités. En analysant la lumière traversant la solution, vous pouvez identifier certains solutés en solution et la concentration de ces substances. Un spectrophotomètre est l`appareil utilisé pour analyser des solutions dans un environnement de laboratoire.
Pas
Partie1 sur 3: Préparation des échantillons

1. Allumez le spectrophotomètre. La plupart des spectrophotomètres doivent se réchauffer avant de pouvoir donner une lecture précise. Allumez l`appareil et laissez-le reposer pendant au moins 15 minutes avant d`analyser les échantillons.
- Utilisez le temps de préchauffage pour préparer vos échantillons.

2. Nettoyer les cuvettes ou tubes à essai. Si vous faites un laboratoire scolaire, vous utilisez peut-être des tubes à essai jetables qui n`ont pas besoin d`être nettoyés. Si vous utilisez des cuvettes ou des tubes à essai réutilisables, assurez-vous qu`ils sont bien nettoyés avant utilisation. Rincer soigneusement chaque cuvette avec de l`eau déminéralisée.

3. Charger le volume d`échantillon approprié dans la cuvette. Certaines cuvettes ont un volume maximum de 1 millilitre (mL) tandis que les tubes à essai peuvent avoir un volume maximum de 5 mL. Tant que le laser qui produit la lumière traverse le liquide et non une partie vide du récipient, vous obtiendrez une lecture précise.

4. Faire une solution de contrôle. La solution de contrôle, ou « vierge », contient uniquement le solvant chimique dans lequel la solution à analyser est dissoute. Par exemple, si vous dissolvez du sel dans de l`eau, votre « blanc » ne contiendra que de l`eau. Si vous colorez l`eau en rouge, le blanc doit également contenir de l`eau rouge. Le blanc a le même volume que la solution à analyser et est conservé dans le même type de récipient.

5. Essuyez l`extérieur de la cuvette. Avant de placer la cuvette dans le spectrophotomètre, vous voulez vous assurer qu`elle est aussi propre que possible pour éviter les interférences de la saleté ou des particules de poussière. Utilisez un chiffon non pelucheux pour éliminer les gouttelettes d`eau ou la poussière qui pourraient se trouver à l`extérieur de la cuvette.
Partie 2 sur 3: Exécution de l`expérience

1. Choisissez et réglez la longueur d`onde de la lumière pour analyser l`échantillon avec. Utilisez une seule longueur d`onde de lumière (couleur monochromatique) pour rendre le test plus efficace. La couleur de la lumière doit être une couleur connue pour être absorbée par l`un des produits chimiques suspectés d`être présents dans la solution d`essai. Réglez la longueur d`onde souhaitée selon les spécifications de votre spectrophotomètre.
- Dans un laboratoire de classe, la longueur d`onde sera probablement donnée.
- Étant donné que l`échantillon reflétera toute la lumière de la même couleur lorsqu`il apparaîtra, la longueur d`onde expérimentale sera toujours d`une couleur différente de celle de l`échantillon.
- Les objets apparaissent sous certaines couleurs car ils reflètent la lumière de certaines longueurs d`onde et absorbent toutes les autres couleurs. L`herbe est verte parce que la chlorophylle dans l`herbe réfléchit la lumière verte et absorbe tout le reste.

2. Calibrer la machine avec le « vierge ». Placer le blanc dans le porte-cuve et fermer le couvercle. Sur un spectrophotomètre analogique, il y aura un écran avec une aiguille qui se déplace en fonction de l`intensité de la détection de lumière. Lorsque le blanc est dedans, vous devriez voir l`aiguille se déplacer vers la droite. Notez cette valeur au cas où vous en auriez besoin plus tard. Avec le flan toujours dans la machine, mettez l`aiguille à zéro avec le bouton de réglage.

3. Retirez le blanc et testez l`étalonnage. Une fois le blanc retiré, l`aiguille doit rester à 0 (zéro) ou l`affichage numérique doit rester à zéro. Remettez le blanc dans l`appareil et vérifiez que l`aiguille ou la lecture ne change pas. Si la machine est bien calibrée avec votre blanc, tout devrait rester à zéro.

4. Mesurez l`absorbance de votre échantillon expérimental. Retirer le blanc et placer l`échantillon expérimental dans l`appareil. Faites glisser la cuvette dans la rainure appropriée et assurez-vous qu`elle est bien droite. Attendez environ 10 secondes que l`aiguille s`arrête ou que les chiffres numériques arrêtent de changer. Noter les valeurs de % transmission et/ou absorbance.

5. Répéter le test avec des longueurs d`onde de lumière successives. Votre échantillon peut contenir plusieurs composés inconnus dont l`absorbance varie en fonction de la longueur d`onde. Pour éliminer l`incertitude, répétez les mesures à des intervalles de 25 nm sur tout le spectre. De cette façon, vous pouvez détecter d`autres produits chimiques que vous soupçonnez être dans le soluté.
Partie 3 sur 3: Analyse des données d`absorbance

1. Calculer la transmission et l`absorbance de l`échantillon. La transmission indique la quantité de lumière qui a traversé l`échantillon a atteint le spectrophotomètre. L`absorption est la quantité de lumière qui a été absorbée par l`un des produits chimiques du soluté. De nombreux spectrophotomètres modernes affichent la transmission et l`absorption, mais une fois que vous avez enregistré l`intensité, vous pouvez calculer ces valeurs.
- La transmittance (T) est trouvée en divisant l`intensité de la lumière qui a traversé la solution échantillon par la quantité qui a traversé le blanc. Il est généralement exprimé en nombre décimal ou en pourcentage. T = je/je0 où I est l`intensité de l`échantillon et I0 l`intensité du blanc.
- L`absorbance (A) est exprimée comme le négatif du logarithme (exposant) de la valeur de transmission (base-10) : A = -logdixt. Pour une valeur T de 0,1, la valeur de A est 1 (0,1 correspond à 10 à la puissance -1), ce qui signifie que 10 % de la lumière est transmise et 90 % est absorbée. Pour une valeur T de 0,01, la valeur de A est 2 (0,01 est 10 à la puissance -2), ce qui signifie que 1% de la lumière est transmise.

2. Tracer les valeurs d`absorbance en fonction des longueurs d`onde. La valeur d`absorbance est tracée sur l`axe vertical des y par rapport à la longueur d`onde de la lumière utilisée pour un test particulier tracé sur l`axe horizontal des x. Le tracé des valeurs d`absorbance maximales pour chaque longueur d`onde de la lumière testée donne le spectre d`absorbance de l`échantillon et identifie les composés qui composent le produit chimique testé et leurs rapports.

3. Comparez votre tracé de spectre d`absorption avec des tracés connus de composés spécifiques. Les composés ont un spectre d`absorption unique et produiront toujours un pic à la même longueur d`onde à chaque fois qu`ils sont mesurés. En comparant vos tracés de composés inconnus avec ceux de composés connus, vous pouvez identifier les solvants qui composent votre solution.
Nécessités
- Spectrophotomètre
- Substance dans la solution à analyser
- Solvant supplémentaire ou solvant (pour une solution à blanc)
- Conteneurs pour solutions à tester et à blanc (cuvettes, tubes à essai, etc.)
Articles sur le sujet "Effectuer une analyse spectrophotométrique"
Оцените, пожалуйста статью
Populaire